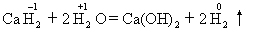| 发现之旅 |  |
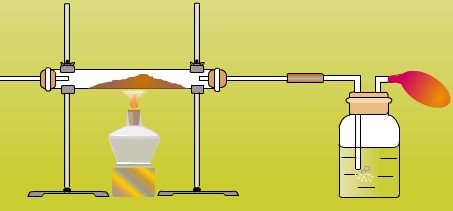
一氧化碳还原氧化铜
| 深入思考 |  |
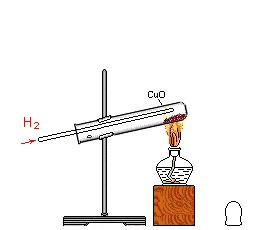
氢气还原氧化铜
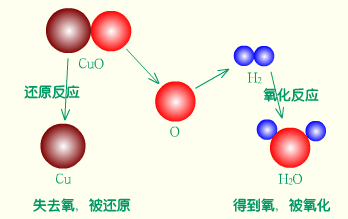
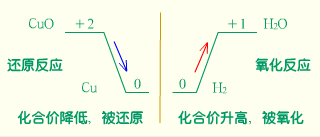
用化合价升降的观点不仅能分析有得氧和失氧关系的反应,还能分析虽没有得氧和失氧关系,但元素化合价在反应前后有变化的反应。
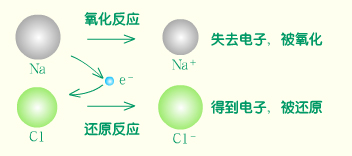
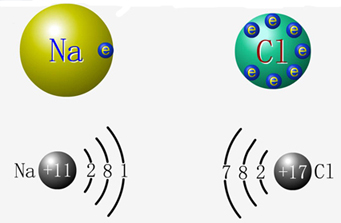
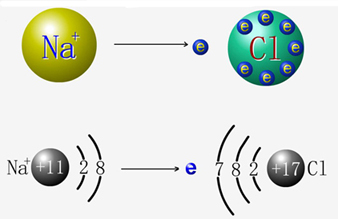
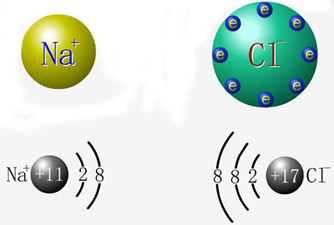
我们知道,元素化合价的升降与电子得失或偏移有密切关系,那么氧化还原反应是否也与电子得失或偏移有着密切的关系呢?下面以氯化钠的形成为例来分析氧化还原反应与电子得失或偏移的关系。
氯化钠的形成

物质在发生氧化还原反应时存在五大规律:
一、表现性质的规律
同种元素具有多种价态时,一般处于最低价时只具有还原性,处于最高价时只具有氧化性,处于中间可变价时既具有氧化性又具有还原性。
二、性质强弱的规律
在“ ”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性强弱顺序是:还原剂>还原产物。
”中,氧化性强弱顺序是:氧化剂>氧化产物;还原性强弱顺序是:还原剂>还原产物。
三、反应先后的一般规律
在浓度相差不大的溶液中,同时含有几种还原剂时,若加入氧化剂,则它首先与溶液中还原性最强的还原剂作用;同理,同时含有几种氧化剂时,若加入还原剂,则它首先与溶液中氧化性最强的氧化剂作用。
四、价态归中的规律
含同种元素不同价态的物质间发生氧化还原反应时,该元素价态的变化一定遵循“高价 + 低价→中间价”的规律。这里的中间价可以相同(谓之“靠拢”),也可以不同,但此时必是高价转变成较高中间价,低价转变成较低中间价(谓之“不相错”)。
在任何氧化还原反应中,氧化剂得电子(或共用电子对偏向)总数与还原剂失电子(或共用电子对偏离)总数一定相等。
| 学有所用 |  |
趣味实验
| 沙场练兵 |  |
1.
下列叙述中,正确的是
( )
A. 含金属元素的离子不一定都是阳离子
B. 在氧化还原反应中,非金属单质一定是氧化剂
C. 某元素从化合态变为游离态,该元素一定被还原
D. 金属阳离子被还原不一定得到金属单质
2.
下列各说法中正确的是
( )
A .在氧化还原反应中,某元素由化合态变为单质,此元素可能被还原,也可能被氧化
B .在氧化还原反应中,可通过比较失去电子数的多少确定还原剂的强弱
C .在氧化还原反应中,非金属单质一定是氧化剂,金属单质一定是还原剂
D .化合物分解的产物有单质,则该分解反应必属于氧化还原反应
3.
氢化钙可作为生氢剂,反应的化学方程式为:CaH2 + 2H2O ==== Ca(OH)2 + 2H2 ↑,下列说法错误的是 ( )
A .CaH2既是氧化剂,又是还原剂
B .H2既是氧化产物,又是还原产物
C .CaH2是还原剂, H2O是氧化剂
D .氧化产物与还原产物的质量比为 1 ∶ 1
4.
1962 年,英国化学家将PtF6和Xe( 氙 )适量混合后,首次制得稀有气体化合物六氟合铂酸氙: Xe + PtF6 → XePtF6。有关此反应的叙述中正确的是( )
A .Xe是氧化剂
B .PtF6是氧化剂
C .PtF6既是氧化剂,又是还原剂
D .该反应属于非氧化还原反应
5.
单质X和Y相互反应生成 X2+ 和Y2- ,现有下列叙述:
①X被氧化 ②X是氧化剂 ③X具有氧化性 ④Y2-是还原产物 ⑤Y2-具有还原性⑥X2+具有氧化性 ⑦Y的氧化性比X2+氧化性强,其中正确的是 ( )
A .①②③④ B .①④⑤⑥⑦ C .②③④ D .①③④⑤
6.
以下关于化学反应 KClO3 +6HCl===KCl+3Cl2 +3H2O 中,电子转移的方向和数目的叙述中,正确的是
( )
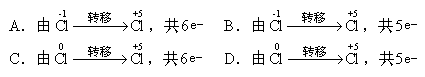

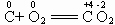 的反应中,
的反应中,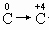 化合价升高,失电子,是还原剂,而
化合价升高,失电子,是还原剂,而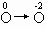 化合价降低,得电子,是氧化剂。C不正确。氧化剂、还原剂的强弱,取决于在化学反应中得、失电子的难易,而与得失电子数多少无必然关系。B不正确。
化合价降低,得电子,是氧化剂。C不正确。氧化剂、还原剂的强弱,取决于在化学反应中得、失电子的难易,而与得失电子数多少无必然关系。B不正确。