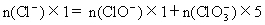| 发现之旅 |  |
很多同学一定都不知道吧,那就让我来告诉大家:这种刺激性气味是氯气散发出来的。 自来水常用氯气(在1 L水中通入约0.002g Cl2)来杀菌消毒。

自来水处理厂的制氯车间
在此之前,对于氯元素我们是从化合物的角度来了解的,而实际上氯也可以以单质的形式存在,那么,今天我们就来从单质的角度了解氯元素!
| 深入思考 |  |

氯气有毒,并有剧烈的刺激性,在实验室里闻氯气气味的时候,必须十分小心,应该用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。

大多数金属在点燃或灼热的条件下,都能与氯气发生反应生成氯化物。例如:铜与氯气的反应。
Cl2 + H2O ==== HClO + HCl
2Ca(OH)2 + 2Cl2 ==== Ca(ClO)2 + CaCl2 + 2H2O

| 学有所用 |  |
氯气消毒
Cl2和H2O发生下列反应:Cl2 +H2O ==== HCl+HClO,HClO是弱酸,pH低时HClO多于ClO- ,如pH=7时(0℃),有83% HClO(余17%为ClO-);20℃时,有75% HClO(ClO-为25%)。
实际消毒情况是:低温和pH低时,消毒效果好;pH低时,消毒速率快。以上事实暗示着HClO消毒效果好。目前的一种解释是:中性HClO扩散到带负电的细菌表面,穿过细胞膜进入细胞内部,氧化某种酶系统。(附:pH大时,HClO少,ClO-多,ClO-带负电,不易接近细菌。)
| 沙场练兵 |  |
1.
关于氯水的叙述正确的是
( )
A .氯水中只含氯分子和水分子
B .新制氯水可使红色石蕊试纸先变蓝后褪色
C .光照氯水有气泡冒出,该气体是氯气
D .氯水放置数天后,pH变小,几乎无漂白性
2.
检验氯化氢气体中是否混有Cl2 ,可采用的方法是
( )
A .用干燥的蓝色石蕊试纸
B .用干燥有色布条
C .将气体通入硝酸银溶液
D .用湿润的淀粉 - 碘化钾试纸
3.
冰箱致冷剂氟氯甲烷在高空中受紫外线辐射产生Cl原子,并进行下列反应:Cl +O3 → ClO + O2 , ClO + O → Cl + O2 下列说法不正确的是
( )
A .反应后将O3转变为O2
B .Cl原子是总反应的催化剂
C .氟氯甲烷是总反应的催化剂
D .Cl原子反复起分解O3的作用
4. 某温度下,将Cl2通入NaOH 溶液中,反应得到NaClO、NaClO3的混合液,经测定ClO-与ClO3-的浓度之比为1:3则Cl2与NaOH 溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A . 21 ∶ 5 B . 11 ∶ 3
C . 3 ∶ 1 D . 4 ∶ 1
5.
下列物质中,能使紫色石蕊试液因漂白而褪色的是
( )
A.NaClO B.活性炭 C.氯水 D.盐酸
6.
今有甲、乙、丙三瓶等体积的新制氯水,浓度均为0.1mol/L。如果在甲瓶中加入少量的NaHCO3晶体(mmol),在乙瓶中加入少量的NaHSO3晶体(mmol),丙瓶不变。片刻后,甲、乙、丙三瓶溶液中HClO的物质的量溶液的大小关系是
( )
A.甲=乙>丙 B.甲>丙>乙
C.丙>甲>乙 D.乙>丙>甲