| 发现之旅 |  |
干电池,学名原电池,是一种化学电源,它是一种把化学能转变为电能的装置。因为这种化学电源装置其电解质是一种不能流动的糊状物,所以叫做干电池,这是相对于具有可流动电解质的电池说的。

| 深入思考 |  |
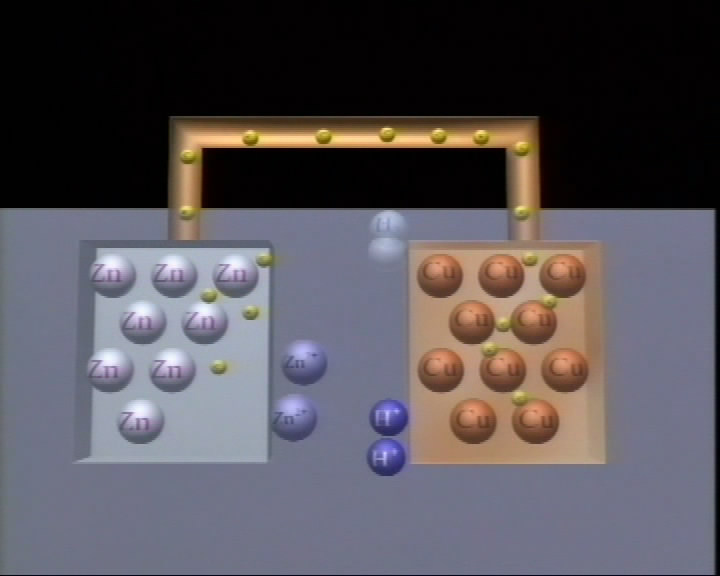
锌片:Zn-2e- ====Zn2+(氧化反应)
铜片:2H++2e- ==== H2↑(还原反应)
总反应:Zn+2H+==== Zn2++H2↑
1、装置特点:将化学能转化为电能
2、形成条件:
(1)要有两种不同的金属(或一种为能导电的非金属),如:铜—锌,锌—锰等;
(2)与电解质溶液接触;
(3)必须形成闭合电路。
| 学有所用 |  |
以上我们介绍了原电池的反应原理,当今的电池工业己能制造出各种各样的实用电池,广泛用于日常生活。如干电池,铅蓄电池等。
下面,简单介绍一种比较常见的电池——干电池。手电筒中的干电池一般是普通的锌—锰干电池,它的结构和反应原理如下:
锌—锰电池内的主要反应:
负极(锌筒):Zn-2e-====Zn2+(氧化反应)
正极(碳棒):2MnO2+2NH4++2e-====Mn2O3+2NH3+H2O
总反应:
Zn+2MnO2+2NH4+====Zn(NH3)22++Mn2O3+H2O
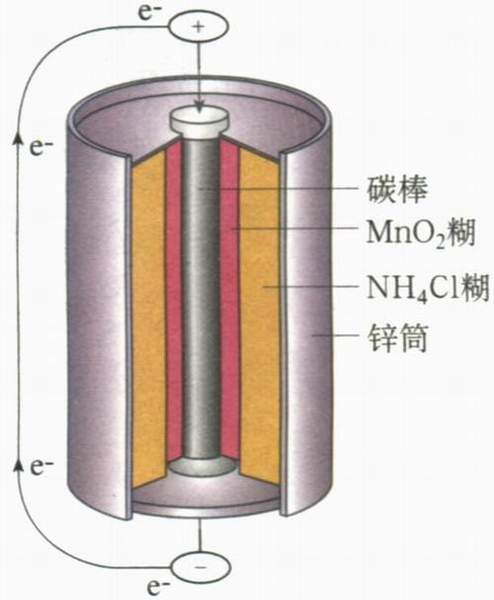
干电池的外壳是金属锌,作负极,中心碳棒(石墨)是正极,碳律周围由一层纸质包裹的黑色物质,这是石墨粉和二氧化锰的混合物,纸质和锌壳之间填满了糊状白色电解液,其成分是氯化铵、氯化锌和淀粉糊。
干电池放电主要是通过锌筒上失去电子,而被氧化成Zn2+而进入电解质溶液中,电解质溶液中的NH4+获得电子被还原成NH3,从而使灯泡在电子转移的过程中获得电能而发光。
| 沙场练兵 |  |
1.
有A、B、C、D四种金属,将A、B用导线连接后浸在稀硫酸中,A上放出氢气,B逐渐溶解生成B2+;在电解含 A2+和 C2+的混合溶液时,阴极上先析出C;将D放入B2+的硝酸盐溶液中,D表面有B析出。这四种金属阳离子的氧化性由强到弱的顺序是( )
A.D2+>B2+>A2+>C2+
B.A2+>B2+>C2+>D2+
C.C2+>A2+>B2+>D2+
D.A2+>C2+>D2+>B2+
2.
将锌片和铜片用导线连接置于同一稀硫酸中,使两极相隔一段较长距离。下列叙述中正确的是( )
A.正极附近![]() 的浓度逐渐增大
的浓度逐渐增大
B.负极附近![]() 的浓度逐渐增大
的浓度逐渐增大
C.负极附近 Zn2+浓度明显增大
D.正极附近H+浓度明显减小
3.
已知空气—锌电池的电极反应为:锌片: ,石墨:
,石墨:
 锌片是( )
锌片是( )
A.负极并被氧化 B.负极并被还原
C.正极并被氧化 D.正极并被还原
4. 把锌片和铁片放在盛有稀食盐水和酚酞溶液的表面皿中,如下图所示.最先观察到酚酞变红现象的区域是( )
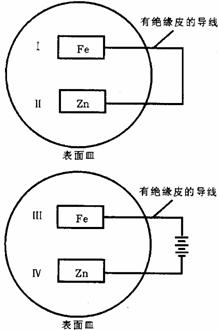
A.Ⅰ和Ⅲ B.Ⅰ和Ⅳ C.Ⅱ和Ⅲ D.Ⅱ和Ⅳ
5.
下列各组中,两种金属用导线相连,插入稀硫酸中,有关叙述正确的是( )
A.导线中的电子由铁极流向银极,溶液中银离子增多
B.导线中的电子由铜极流向锌极,溶液中锌离子增多
C.导线中的电子由铁极流向铜极,溶液中铜离子增多
D.导线中的电子由锌极流向铁极,溶液中锌离子增多