| 发现之旅 |  |
你知道三大强酸吗?对,它们是盐酸(HCl)、硫酸(H2SO4)和硝酸这三种无机酸。相信前两者对于大家来说一定不会陌生,今天,向大家介绍的便是酸家族中的重要一员——硝酸(HNO3)。

| 深入思考 |  |
原来硝酸见光易分解产生NO2,NO2溶于水显黄色。所以我们在实验室中常用的硝酸是略带黄色的。且硝酸的浓度越大越易分解,而且温度越高分解越快,光越强分解越快。 为了防止硝酸的分解,必须把它盛在棕色瓶里密封存放在黑暗而且温度较低的地方。
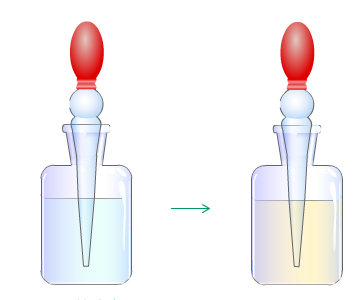
硝酸见光易分解
硝酸在化学性质上,除了具有酸的通性外,还具有本身的特性:氧化性。
我们在学习酸的通性时知道:酸能和金属发生反应,生成一种金属盐和氢气。但是我们今天要学习的硝酸却是一个例外,它与金属也能反应,但是产生的气体不是氢气。想知道它们反应生成的是什么吗?那就继续往下看吧!
首先我们来看一个实验:浓硝酸和稀硝酸分别与铜的反应。
在常温下,稀硝酸与铜在并不发生反应。(见下图右边试管)


有些金属如铝、铁等在冷的浓硝酸中会发生钝化现象,这是因为浓硝酸把它们的表面氧化成一层薄而致密的氧化膜,阻止了反应的进一步进行。
| 学有所用 |  |
钝化现象
如果在室温时试验铁片在硝酸中的反应速率以及与硝酸浓度的关系,我们将会发现铁的反应速率最初是随硝酸浓度的增大而增大。当增大到一定程度时,它的反应速率迅速减小,继续增大硝酸的浓度时,它的反应速率更小,最后不再起反应,即铁变得“稳定”了,或者像一般所说的,铁发生“钝化”了。
不仅铁,其他一些金属也可以发生钝化。例如,Cr、Ni、Co、Mo、Al、Ta、Nb和W等,其中最容易钝化的金属是Cr、Mo、Al、Ni、Fe。
不仅硝酸,其他强氧化剂如浓硫酸、氯酸、碘酸、重铬酸钾、高锰酸钾等,都可以引起金属的钝化。
在个别情况下,少数金属能在非氧化剂介质中钝化。例如,镁在HF中钝化,钼和铌在HCl中钝化。
一般地说,钝化后的金属,在改变外界钝化条件后,仍能在相当程度上保持钝化状态。例如,铁在浓硝酸中钝化后,不仅在稀硝酸中保持稳定,而且在水、水蒸气及其他介质中也能保持稳定。钝化后的铁不能从硝酸铜溶液中置换出铜。
钝化能使金属变得稳定。从本质上讲,这是由于金属表面上覆盖了一层氧化膜,因而提高了金属的抗蚀性能。
为了提高金属的防护性能,可采用化学方法或电化学方法,使金属表面覆盖一层人工氧化膜。这种方法就是通常说的氧化处理或发蓝。它在机械制造、仪器制造、武器、飞机及各种金属日用品中,作为一种防护装饰性覆盖层而广泛地被采用。
| 沙场练兵 |  |
1.
下列反应中, HNO3既显氧化性,又显酸性的是 ( )
A.Cu和HNO3 B.CuO和HNO3
C.H2S和HNO3 D.FeO和HNO3
2.
稀硫酸中加入铜片,无现象,再加入下列某物质后,见铜片逐渐溶解,溶液呈蓝色。该物质为
( )
A.NaCl B.KNO3
C.Cu(OH)2 D.Fe
3.
将 1.92 g 铜粉与一定量浓硝酸反应,当铜粉完全作用时,收集到的气体为 1.12 L (标准状况),则所消耗的硝酸的物质的量是
( )
A.0.12 mol B.0.11 mol
C.0.10 mol D.0.08 mol
4.某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物。当参加反应的单质与被还原硝酸的物质的量之比为2:1时,其还原产物是( )
A.NO2 B.NO
C.N2O D.N2


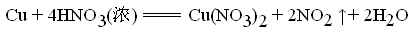
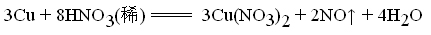
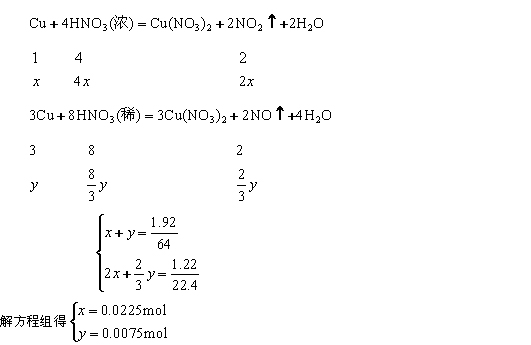
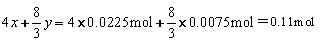
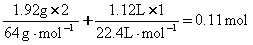
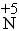 被还原后显+3价。
被还原后显+3价。