| 发现之旅 |  |
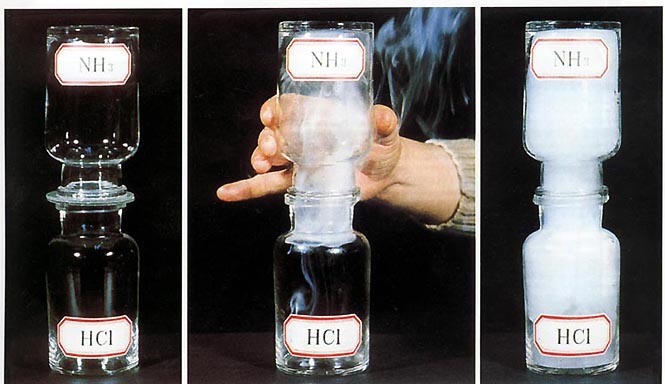
原来,经过这种化学处理的棉布(防火布)的表面附满了氯化铵的晶体颗粒,当氯化铵遇热就会发生化学变化:NH4Cl→NH3(g)+HCl(g)。分解出两种不能燃烧的气体,一种是氨气,另一种是氯化氢气体。这两种气体把棉布与空气隔绝起来,棉布在没有氧气的条件下当然就不能燃烧了。当这两种气体保护棉布不被火烧的同时,它们又在空气中相遇,重新化合而成氯化铵小晶体,这些小晶体分布在空气中,就象白烟一样。
| 深入思考 |  |
 |
||
氯化铵固体 |
||
| 氨气和氯化氢气体在常温下就能发生反应生成氯化铵。 | ||
NH3+HCl===NH4Cl |
||
| 氨气是一种没有颜色、有刺激性气味的气体,对人的眼、鼻、喉等有刺激作用,分子式为NH3,在它的分子中,N 和H 以3个极性共价键相结合,它的分子结构成三角锥形,其中 N 原子位于锥顶。 | ||
 |
||
氨分子结构 |
||
| 氨气除了能和氯化氢反应以外,还能与水反应: | ||
| 从实验中可以看到,在圆底烧瓶中形成漂亮的红色喷泉,而且溶液逐渐充满整个烧瓶,由此可知氨气易溶于水。在常温常压下,一般1体积水能溶解700体积氨气。 氨的水溶液叫做氨水,氨溶于水时,大部分NH3与H2O结合,形成一水合氨(NH3.H2O)。NH3.H2O可以部分电离成NH4+和OH —,所以我们可以看到,喷泉的颜色为红色,也就是说氨气溶于水后的溶液显碱性,能使酚酞试液变红。 |
||
| NH3.H2O很不稳定,受热时容易分解,生成NH3和H2O。 | ||
| 此外,氨气还能和氧气发生反应,但是必须要在催化剂存在的条件下加热,反应才能进行。 | ||
| 此反应叫做氨的催化氧化,用于工业上制硝酸。 氨是一种重要的化工产品,是氮肥工业和有机合成工业上的常用原料。另外,由于氨气很容易液化,但在液化的同时放出大量的热,而液氨汽化时需要吸收大量的热,使周围温度急剧下降,所以液氨可以用做致冷剂。 |
||
|
||
关于氨气的还原性 |
||
| 在氨分子中,氮原子与氢原子间的共用电子对均偏向于氮原子,故在氨中,氮元素显 -3价 ( 最低价 ) ,在适当条件下氨与氧化剂相遇,可以发生氧化还原反应,而使氮元素化合价升高,如氨在纯氧中可以燃烧,生成氮气和水。 | ||
氨也可以与氯气反应(因氯气是一种较强的氧化剂) 。 |
||
2NH3 +3Cl2 === N2 +6HCl |
||
应当指出,氨遇到的氧化剂不同,反应条件不同,氨中氮元素化合价升高的价态亦是不同的。 |
||
8NH3 +3Cl2 === 6NH4 Cl+N2 |
||
|
||
1.
某混合气体可能含有CO,CO2 ,NH3 ,HCl,H2 和水蒸气中的一种或几种,当依次通过澄清石灰水(无浑浊现象)、氢氧化钡溶液(有浑浊现象)、浓硫酸、灼热氧化铜(变红色固体)和无水硫酸铜(出现蓝色),由此可以判定该混合气体一定含有( )
|
||
2. 密度为
|
||
3.对NH4Cl中化学键类型的叙述,正确的是( )
|
||
4.下列说法中,错误的是( )
|
||