| 发现之旅 |  |

今天我们就来从本质上认识溶液的酸碱性!
| 深入思考 |  |
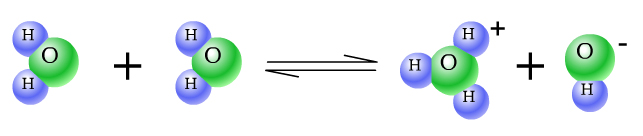
水的电离过程示意图
Kw叫做水的离子积常数,简称为水的离子积。水的离子积是—个很重要的常数.它反映了一定温度下的水中H+浓度和OH-浓度之间的关系。在25℃时,水中 H+浓度和OH-浓度都是1×10-7mol/L,所以
Kw = c(H+)·c(OH-) =1×10-7 ×1×10-7 = 1×10-14
化学上常采用pH来表示溶液酸碱性的强弱:
pH = -lg{c(H+)}
常温时,溶液的酸碱性与c(H+)和c(OH-)的关系可以表示如下:
中性溶液 c(H+) = c(OH-) = 1×10-7 mol/L , pH = 7
酸性溶液 c(H+) > c(OH-),c(H+) > 1×10-7 mol/L ,pH < 7
碱性溶液 c(H+) < c(OH-),c(H+) < 1×10-7 mol/L, pH > 7
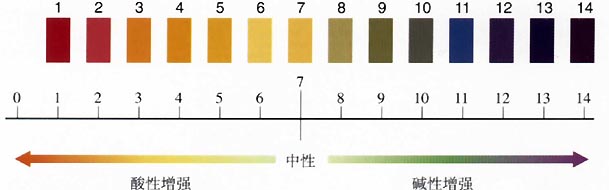
与溶液酸碱性的关系

| 学有所用 |  |
测定溶液pH的实际意义

溶液pH的测定
| 沙场练兵 |  |
1.
向10mLpH=2的某酸溶液中加入10mLpH=12的KOH溶液,反应后再滴入石蕊溶液,溶液显红色,则此溶液可能是下列中的
( )
A.一元强酸 B.二元强酸 C.一元弱酸 D.任何强酸
2.
25℃的下列溶液中,碱性最强的是
( )
A.pH = 11的溶液
B.c(OH-) = 0.12 mol/L的溶液
C.1L中含有4g NaOH的溶液
D.c(H+) = 1×10-10 mol/L的溶液
3.
常温下,某溶液中由水电离产生的c(H+)=1×10-11 mol/L,则该溶液的pH可能是
( )
A. 3 B. 7 C. 8 D. 11
4.
将pH为3和pH为5的稀盐酸等体积相混合,所得溶液的pH为
( )
A. 3.7 B. 3.3 C. 4.7 D. 5.3
5.
室温下,在pH=12的某溶液中,由水电离的c(OH-)为( )
A.1.0 × 10-7 mol/L B.1.0 ×10-6 mol/L
C.1.0 × 10-2 mol/L D.1.0 × 10-12 mol/L
6.
pH=5的盐酸和pH=9的氢氧化钠溶液以体积比 11∶9 混合,混合液的pH为
( )
A. 7.2 B. 8 C. 6 D. 无法计算
 知:由水电离产生的c(
知:由水电离产生的c( =1×10-3mol/L,即
=1×10-3mol/L,即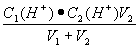 =
= 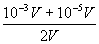 =5.05×10-4mol/l
=5.05×10-4mol/l