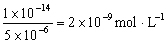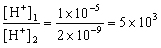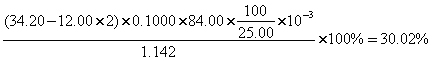| 发现之旅 |  |
在定量分析中,用已知物质的量浓度的酸(或碱)来测定未知物质的量浓度的碱(或酸)的方法就叫做酸碱中和滴定。酸碱中和滴定常用的仪器如图所示。
 |
 |
 |
滴定装置 |
碱式滴定管 |
酸式滴定管 |
| 深入思考 |  |
H+ + OH - = H2O
首先来看盐酸和氢氧化钠的中和滴定实验:
HCl + NaOH ==== NaCl + H2O
根据滴定过程中所用区的盐酸溶液的体积,可以很容易计算出氢氧化钠溶液的浓度。
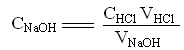
NaOH与HCl混合过程中的pH变化
指示剂的颜色变化都是在一定的pH范围内发生的,我们把指示剂发生颜色变化的pH范围叫做指示剂的变色范围。下图显示了常用的指示剂(石蕊试剂和甲基橙试剂)在酸性、碱性、中性溶液中的颜色变化。
 |
 |
甲基橙在酸性、中性、碱性溶液中的颜色 |
石蕊在酸性、中性、碱性溶液中的颜色 |
酸碱中和滴定操作简便、快速,并且具有足够的准确度。在工农业生产和科学研究中具有很大的实用价值。
| 学有所用 |  |
酸碱性食物的合理搭配
最近人们一直在提酸碱性食物,那么究竟如何合理的搭配算碱性食物呢?这要从人体内的环境来谈一下。人体内环境基本是中性的,略偏碱性。在新陈代谢过程中产生的大量酸性物质,都被血液中的缓冲物质所中和,不致于使人体内部环境呈酸性,但有时也可造成紊乱。如人患腹泻时,排出物呈碱性,体内酸会相对增多而呈酸性;大量呕吐时,胃酸损失过多,体内又可呈碱性。而且每餐进食,食物都有一定的酸碱度,也会影响人体的酸碱平衡。
而所谓食物的酸碱性,是说食物中的无机盐属于酸性还是属于碱性。

一些食物中含有较多的非金属元素,如磷、硫、氯等,在人体内氧化后,生成带有阴离子的酸根,属于酸性食物。如猪肉、牛肉、鸡肉、鸭、蛋类、鲤鱼、牡蛎、虾,以及面粉、大米、花生、大麦、啤酒等。
因此,家常菜一定要注意酸、碱食物的合理搭配,否则,进食酸性食物过多,可造成血液偏酸性。为中和这些酸性物质,又必然消耗体内大量的钙、镁等碱性元素,而引起缺钙等一系列症状,如皮肤病、神经病,特别是在节假日里,如果肉类较多,就更应该注意搭配一些新鲜蔬菜、水果等碱性食物,以免造成机体酸碱平衡失调。
| 沙场练兵 |  |
1.用NaOH滴定pH相同、体积相同的HS2O4、HCl、CH3COOH三种溶液,恰好中和时,所用相同浓度NaOH溶液的体积依次为V1、V2、V3,则这三者的关系是( )
A.V1>V2>V3
B.V1 <V2<V3
C.V1 = V2 >V3
D.V1 = V2<V3
2.下列是一段关于中和滴定的实验叙述:
⑴ 取一锥形瓶,用待测NaOH溶液润洗两次;
⑵ 在锥形瓶中放入25 ml待测液NaOH溶液;
⑶ 加入几滴石蕊试剂作指示剂;
⑷ 取一支酸式滴定管,洗涤干净后;
⑸ 直接往其中注入标准酸溶液,进行滴定;
⑹ 左手旋转滴定管的玻璃活塞,右手不停摇动锥形瓶;
⑺ 两眼注视着滴定管内盐酸溶液液面下降,直至滴定终点;
其中错误的是( )
A. ⑷⑹⑺ B. ⑴⑸⑹⑺ C. ⑶⑸⑺ D. ⑴⑶⑸⑺
3.用标准NaOH溶液滴定盐酸时,若配制标准溶液称取NaOH固体中含有下列杂质时,会引起结果偏低的是( )
A.NaCl B.Na2O
C.Na2CO3 D.NaHCO3
4.用0.01mol/LH2SO4溶液滴定0.01 mol/LNaOH溶液,中和后用水稀释至100mL。若在滴定操作中有误:①或多加1滴稀硫酸;②或多加1滴NaOH溶液(设每mL溶液约为20滴),则①和②两次滴定后溶液中[H+]之比为( )
A.10 B.50 C.5×103
D.104
5.中和滴定开始后应注视:①滴定管内液面的变化,②锥形瓶中溶液颜色的变化,③滴定管端液流出的速度( )
A.①和② B.②和③
C.①和③ D.②
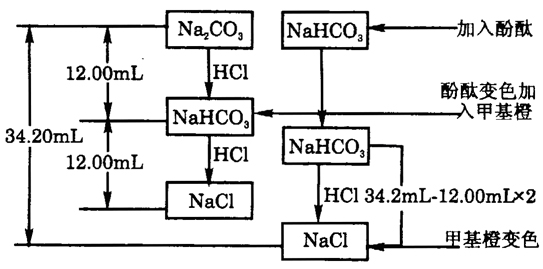
6.用中和滴定法测定我国宁夏出产的冰碱(主要成分是Na2CO3和NaHCO3,杂质难溶于水,且不与酸反应)中NaHCO3的含量。首选称取冰碱试样1.142g。用水溶解、过滤,将滤液配成100 mL溶液A。然后采取下列实验步骤进行滴定:①用移液管向锥形瓶中移入25.00 mL A溶液,并加入酚酞试液3滴; ②向酸式滴定管中加入0.1000 mol·L-1的盐酸至0刻度线;③向其中加入甲基橙试液3滴,用0.1000mol·L-1的盐酸滴定至溶液变为红色,共用去盐酸34.20mL;④滴定至酚酞红色恰好褪去,读数为12.00mL;⑤用0.1000mol·L-1的盐酸润洗酸式滴定管三次;⑥用溶液A洗涤25 mL移液管三次。
(1)正确的实验操作步骤是( )或( )
A.⑥①⑤②④③ B.⑤②⑥①④③
C.①②③④⑤⑥ D.②①③④⑤⑥
(2)计算冰碱中NaHCO3的质量分数
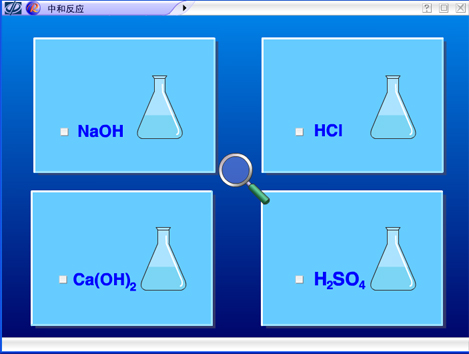

 。对于反应前后溶液总体积变化不大,可以忽略不计。
多加一滴H2SO4溶液时,剩余H+离子浓度为
。对于反应前后溶液总体积变化不大,可以忽略不计。
多加一滴H2SO4溶液时,剩余H+离子浓度为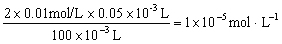
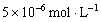 ,这时溶液中的H+浓度为
,这时溶液中的H+浓度为