组成物体的分子间虽有空隙,但大量分子却能聚集在一起形成固体或液体,固体和液体很难被压缩,拉伸物体需要力,种种事实表明分子间存在相互作用力.
一、分子间存在相互作用力
1.分子间存在相互作用的引力(如:压紧的铅块结合在一起,它们不易被拉开)
2.分子间存在相互作用的斥力(如:固体和液体很难被压缩)
压缩气体也需要力,不说明分子间存在斥力作用,压缩气体时需要的力是用来反抗大量气体分子频繁撞击容器壁(活塞)时对容器壁(活塞)产生的压力.
3.分子间的引力和斥力同时存在,实际表现出来的分子力是分子引力和斥力的合力(分子力).
二、分子间相互作用力的特点
1.分子间的引力和斥力同时存在.
2.分子间的引力和斥力只与分子间距离(相对位置)有关,与分子的运动状态无关.
3.分子间的引力和斥力都随分子间的距离r的增大而减小,且斥力总比引力随r的增大衰减得快.
三、分子力与距离的关系示意图
如下图所示,F>0为斥力,F<0为引力,横轴上方的虚线表示分子间斥力随r的变化图线,横轴下方的虚线表示分子间引力随r的变化图线,实线为分子间引力和斥力的合力F(分子力)随r的变化图线.
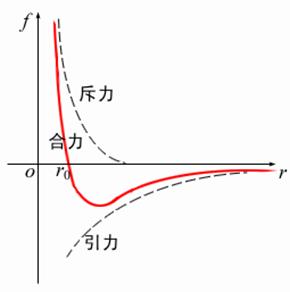
1.当r=r0时,分子间引力和斥力相平衡,F引=F斥,分子处于平衡位置,其中r0为分子直径的数量级,约为
10-10m.
2.当r<r0时,F引=F斥,对外表现的分子力F为斥力.
3.当r>r0时,F引=F斥,对外表现的分子力F为引力.
4.当r>10r0时,分子间相互作用力变得十分微弱,可认为分子力F为零(如气体分子间可认为作用力为零).
四、引起分子间相互作用力的原因
分子间相互作用力是由原子内带正电的原子核和带负电的电子间相互作用而引起的.
