| 发现之旅 |  |
| 深入思考 |  |
设计制备物质实验方案的程序和思路
1.程序
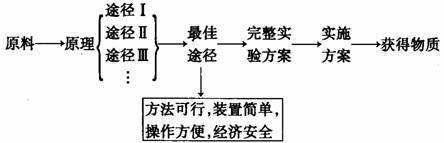
2.思路
实验方案设计要求学生联系所学过的实验知识、实验技能以及实验条件,进行知识类比、迁移、重组.合理、周密地思考才能设计出正确的实验方案。
(1)思考问题的顺序
①思考完成实验的最佳途径:由原料到产品,制取方法不止一种,选择适当的实验途径、实验用品是实验成败的关键。
②思考有关物质的制备、净化、吸收和存放等问题。例如,制取在空气中易水解的物质(如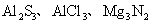 等)及易受潮的物质时,往往在装置的末端接一个干燥装置,以防止空气中水蒸气进入。
等)及易受潮的物质时,往往在装置的末端接一个干燥装置,以防止空气中水蒸气进入。
③思考合理地组装仪器。例如:涉及气体的制备和处理时,实验的操作顺序及装置的连接顺序应为:发生→除杂质→干燥→收集→尾气处理。
(2)操作顺序
①组装仪器:自下而上,从左到右;气体净化时,先洗气,后干燥。
②检查气密性(制备气体时的操作)。
③装药品进行实验操作。
④记录实验现象。
⑤拆卸、洗涤仪器.拆卸时应该自右而左、从上到下。
(3)物质制备应遵循的原则
①条件合适,操作方便。②设计合理,步骤简单.③原料易得,价格低廉.④产物纯净,产量较高.⑤易于分离,污染物少。
制取气体实验的操作程序和实验中应思考的问题
在中学化学实验中,制取气体的流程一般是:发生气体→除去杂质→收集气体→处理尾气。制取气体的操作顺序一般是:装配装置,检验装置的气密性,加反应物,施用条件发生反应,收集气体,检验气体是否收满,处理尾气。实验中应思考的问题包括:利用所制取的气体怎样完成它的性质实验,如果是进行定量实验,应考虑怎样准确测定实验数据,要测定哪些数据,会产生什么误差,如何减小误差等。
1.程序

2.思路
实验方案设计要求学生联系所学过的实验知识、实验技能以及实验条件,进行知识类比、迁移、重组.合理、周密地思考才能设计出正确的实验方案。
(1)思考问题的顺序
①思考完成实验的最佳途径:由原料到产品,制取方法不止一种,选择适当的实验途径、实验用品是实验成败的关键。
②思考有关物质的制备、净化、吸收和存放等问题。例如,制取在空气中易水解的物质(如
③思考合理地组装仪器。例如:涉及气体的制备和处理时,实验的操作顺序及装置的连接顺序应为:发生→除杂质→干燥→收集→尾气处理。
(2)操作顺序
①组装仪器:自下而上,从左到右;气体净化时,先洗气,后干燥。
②检查气密性(制备气体时的操作)。
③装药品进行实验操作。
④记录实验现象。
⑤拆卸、洗涤仪器.拆卸时应该自右而左、从上到下。
(3)物质制备应遵循的原则
①条件合适,操作方便。②设计合理,步骤简单.③原料易得,价格低廉.④产物纯净,产量较高.⑤易于分离,污染物少。
制取气体实验的操作程序和实验中应思考的问题
在中学化学实验中,制取气体的流程一般是:发生气体→除去杂质→收集气体→处理尾气。制取气体的操作顺序一般是:装配装置,检验装置的气密性,加反应物,施用条件发生反应,收集气体,检验气体是否收满,处理尾气。实验中应思考的问题包括:利用所制取的气体怎样完成它的性质实验,如果是进行定量实验,应考虑怎样准确测定实验数据,要测定哪些数据,会产生什么误差,如何减小误差等。
| 学有所用 |  |
硫酸亚铁的制备
实验说明
首先用碱液除去废铁屑表面的油污。制备硫酸亚铁的操作如下:
(1)在烧杯中倒入40 mL稀硫酸,加入足量废铁屑,以使稀硫酸浸没所有铁屑为度。小心加热(保持温度在50℃~80℃之间,不要煮沸),直到只有极少量气泡发生,同时溶液呈浅绿色为止(这时烧杯底部仍应留有少量铁屑)。
(2)用少量热水通过过滤器,以提高它的温度(防止溶液在漏斗里析出晶体),然后将溶液趁热过滤。将滤液转入试管中,用橡皮塞塞住管口(防止空气进入),静置、冷却、结晶,观察滤液冷却生长出浅绿色硫酸亚铁晶体的现象。
(3)待结晶完毕后,取出晶体,用少量水洗涤2~3次,再用滤纸将晶体吸干。
(4)把制得的硫酸亚铁晶体放在一个小广口瓶中,密闭保存。
点击上图观看“以废铁屑和废硫酸为原料制备硫酸亚铁”视频
| 沙场练兵 |  |
1. 用下图实验装置制取某无色非金属氧化物气体,请选择A~D序号填入空格内.
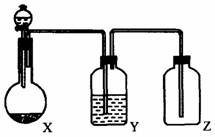
(1)烧瓶X与分液漏斗内的药品应是( )
A.二氧化锰和双氧水
B.铜和浓硝酸
C.电石与水
D.亚硫酸钠和浓盐酸
(2)洗气瓶Y中所装的液体应是(其作用是不允许非水杂质混在气体中)( )
A.浓硫酸 B.NaOH溶液
C.饱和![]() 溶液 D.
溶液 D.![]() 溶液
溶液
(3)检验集气瓶Z是否集满气体,置于瓶口的滤纸应蘸的溶液是( )
A.氯化钡溶液 B.酸性高锰酸钾溶液
C.碘化钾淀粉溶液 D.品红溶液
2. 我国化学侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如图:
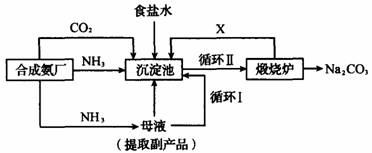
(1)上述生产纯碱的方法称________,副产品的一种用途为________.
(2)沉淀池中发生的化学反应方程式是________.
(3)写出上述流程中X物质的分子式________.
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环.从沉淀池中取出沉淀的操作是________.
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴加________。
(6)向母液中通氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有________。
a.增大![]() 的浓度,使
的浓度,使![]() 更多地析出
更多地析出
b.使![]() 更多地析出
更多地析出

