| 发现之旅 |  |
既然在稀释的过程中都有能量的变化,那么在发生了化学变化的反应中能量是否发生了变化呢?有变化,在化学变化的同时既有物质的变化,也有能量的变化。而且常以热能的形式表现出来。
| 深入思考 |  |
例如:铝片与盐酸的反应就是一个放热反应。
从实验中可以看到,随着反应的进行,温度计中的水银柱越升越高。因此也说明了铝与盐酸的反应是放热反应。
氢氧化钡晶体与氯化桉晶体的反应就是一个吸热反应。
氢氧化钡晶体与氯化桉晶体的反应就是一个吸热反应。
在化学反应过程中放出或吸收的热量为反应热。反应热用符号△H表示,单位一般采用kJ/mol。
当△H为“-”或△H<0时,为放热反应;
当△H为“+”或△H>0时,为吸热反应。
例如:氢气与氯气反应的热化学反应方程式。
H2 (g) + Cl2 (g) ===== 2HCl(g);△H=-184.6 kJ/mol
即表明了1mol气态H2 与 1 mol气态Cl2反应生成2mol气态 HCl,放出 184.6kJ的热量。从热化学方程式可以明显地看出反应过程中需要吸收或放出的热量。
书写热化学方程式时应注意以下几点:
1、需注明反应的温度和压强,因反应的温度和压强不同时,其△H也不同。但中学所用的△H的数据,一般都是在101kPa和25℃时的数据,因此可不特别注明。但需注明△H的“+”与“-”。
2、要注明反应物和产物的状态。物质呈现哪一种聚集状态,与它们所具有的能量有关。例如,冰熔化为水时,需要吸收热量,水蒸发为水蒸气时,也需要吸收热量(如下图),因此,水在蒸气状态时所具有的能量与液态或固态时所具有的能量是不相同的。这也就是为什么H2与O2反应生成2molH2O(l)与生成2mol H2O(g)时所放出的热量不同的原因。
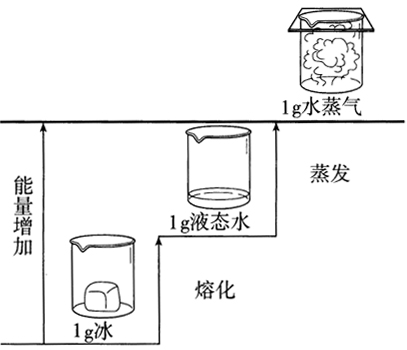
许多化学反应的反应热可以直接测得。但有些化学反应的反应热不能直接测得,需通过计算求得。正确书写热化学方程式对于生产和科学研究有重要意义。
| 学有所用 |  |
盖斯定律及其应用
1840年,盖斯(G.H.Hess,俄国化学家)从大量的实验事实中总结出一条规律:化学反应不管是一步完成还是分几步完成,其反应热是相同的。也就是说,化学反应的反应热只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。
如果一个反应可以分几步进行,则各分步反应的反应热之和与该反应一步完成时的反应热相同,这就是盖斯定律。
盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但利用盖斯定律不难间接计算求得。例如,对于反应:
![]()
![]()
| 沙场练兵 |  |
1. 对于 2H2(气)+O2(气) ==== 2H2O(气)+483.6kJ 热化学方程式,下列说法正确的是
( )
A. 氢气与氧气反庆吸收热量 483.6kJ
B. 氢气燃烧反应的反应热为 483.6kJ
C. 2 个 H2 分子燃烧生成水蒸气放出 483.6kJ
D. 2mol H2 与 1mol O2 生成 2mol 水蒸气放出 483.6kJ 热
2. 在标准状况下,1LH2在O2 中完全燃烧生成液态水时放出12.76 千焦热量,则H2燃烧的热化学方程式为
( )
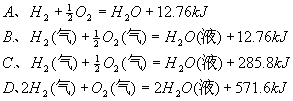
3.
下列说法中正确的是
( )
A. 反应热指的是反应过程中放出的热量
B. 热化学方程式的系数意义之一是表示分子的个数
C. 在热化学方程式中生成物必须标明取聚集状态
D. 所有的化学反应都伴随着能量的变化
4.
在相同温度下,下列两个反应放出的热量分别用Q1和Q2表示,
2H2(气)+O2(气)===2H2O(气)+Q1 ;
2H2 (气) +O2(气) ===2H2O(液)+Q 2 ,
则Q1和Q2的关系是( )
A. Q1 =Q2 B. Q1>Q2 C. Q1<Q2 D. 2Q2 =Q1
5. 已知下列两个热化学方程式:
2H2(气)+O2(气)==== 2H2O(液)+571.6kJ
C3H8(气)+5O2(气 )==== 3CO2(气)+4H2O(液)+2220.0kJ
实验测得H2与C3H8的混合气体共5mol ,完全燃烧时放热387.4kJ ,则混合气体中H2与C3H8体积比是( )
A. 1:3 B. 3:1 C. 1:4 D. 1:1
6. 已知:
CH4(气)+2O2(气)=== CO2(气)+2H2(液)+Q1
2H2(气)+O2(气)==== 2H2O(气)+ Q2
2H2(气)+O2(气)==== 2H2O(液)+ Q3
常温下,取体积比 4 ∶ 1 和 CH4 和 H2 的混合气体 11.2L( 标准状况下 ) 经完全燃烧后恢复到常温,则放出的热量为:( )
A. 0.4Q1 +0.05Q3 B. 0.4Q1 +0.05Q2 C. 0.4 Q1 +0.1Q3 D. 0.4 Q1 +0.2Q3



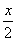 +(5-x)×2220=3847
所以x=3.75mol,由体积之比等于物质的量之比3.75:(5-3.75)=3:1 选B
+(5-x)×2220=3847
所以x=3.75mol,由体积之比等于物质的量之比3.75:(5-3.75)=3:1 选B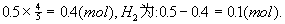 根据CH4燃烧的热化方程式可知,0.4mol甲烷燃烧会放出0.4Q1的热量。而0.1molH2燃烧后恢复到室
温,生成的H2O一定为液态所以不能选择生成气态水放出O2热量的热化学方程式进行运算,而应选择生
成液态H2O的。故0.1molH2燃烧可放出0.05Q3的热量。所以正确答案为A。
根据CH4燃烧的热化方程式可知,0.4mol甲烷燃烧会放出0.4Q1的热量。而0.1molH2燃烧后恢复到室
温,生成的H2O一定为液态所以不能选择生成气态水放出O2热量的热化学方程式进行运算,而应选择生
成液态H2O的。故0.1molH2燃烧可放出0.05Q3的热量。所以正确答案为A。