| 发现之旅 |  |

在今天的学习中,我们主要研究的就是如何将电能转化为化学能。
| 深入思考 |  |
在一个U型管中加入氯化铜溶液,插入两根石墨电极,接上直流电源,电源正极与阳极相连,负极与阴极相连。观察U型管中发生的现象。
将湿润的碘化钾淀粉试纸放在阳极附近,观察试纸颜色的变化。

氯化铜在水溶液中能电离生成Cu2+和Cl-,通电前Cu2+和Cl-在溶液中自由的移动着,通电后,在电场的作用下,Cu2+和Cl-开始作定向移动,且Cu2+向阴极移动,获得电子被还原成铜;Cl-向阳极移动,失去电子被氧化成氯原子,氯原子再结合生成氯气。两个电极上的反应为:
阳极:2Cl- - 2e- === Cl2
阴极:Cu2+ + 2e- ==== Cu
在氯化铜溶液中还存在着水的电离平衡:
| 学有所用 |  |
1、电解池电极的判断:
根据与电源相连情况:与正极相连——阳极,与负极相连——阴极;根据电子流动方向:电子由电源负极流向阴极,由阳极流回电源正极;根据电流方向:电流方向与电子流动方向相反;根据离子运动方向:阴离子移向阳极,阳离子移向阴极。根据电池中的反应:阳极——失去电子,发生氧化反应;阴极——得到电子,发生还原反应。
2、如何判断电解时的电解产物?
阴极: 阴极本身不会参与电极反应,而是电解质溶液中的离子参与电极反应。
(1) 金属活动性顺序表中排在Al后面的金属的离子在水溶液中总是首先获得电子,Mn+ + ne- ==== M 。
(2) 金属活动性顺序表中排在 Al 前面的金属 (包括 Al) 的金属离子,在水溶液中不放电,放电的是 H+ 离子: 2H+ + 2e- ==== H2 ↑
可见,一些强的金属如Na ,Mg ,Al 等不可能通过电解其盐的水溶液得到。通常采用熔盐电解。
阳极:
(1) 除Pt,Au 以外,其它可溶性阳极首先失去电子,所以判断电解产物时,要注意电极材料。
(2) 当惰性电极上含有如S2- ,I- ,Br-,Cl- 等简单离子时,是这些离子失去电子,而OH- 不失电子,如: 2Cl- ==== Cl2+ 2e-
当不含有简单离子,而含有复杂离子时,复杂离子一般不被氧化,而是OH- 放电: 4OH-==== 2H2O+O2 ↑+4e -
(但在电解 K2MnO4 碱性溶液时,在阳极上MnO42-失电子,生成KMnO4)
| 沙场练兵 |  |
1. 下图中X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出。符合这一情况的是( )

a极板 b极板 X电极 Z溶液
A. Zn C 负极 CuSO4
B. C C 负极 NaOH
C. Ag Fe 正极 AgNO3
D. Cu C 负极 CuCl2
2. 在25 ℃时将两个铜电极插入一定质量的Na2SO4饱和溶液中进行电解。通电一段时间后,阴极上逸出a mol气体,同时有w g Na2SO4 ·10H2O晶体析出。若温度不变,剩余溶液中溶质的质量分数为( )

3. 用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH值下降的是( )
A.CuSO4 B.AgNO3 C.BaCl2 D.H2SO4
4. 以铂为阳极,铜为阴极,电解硫酸铜水溶液,在阳极和阴极上析出物质的质量比是 ( )
A.1∶8 B.8∶1 C.1∶4 D.4∶1
5. 用铂作电极电解一定浓度的下列物质的水溶液.电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是( )
A.AgNO3 B.H2SO4 C.NaOH D.NaCl
6. 将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为( )
A.1∶2∶3 B.3∶2∶1
C.6∶3∶1 D.6∶3∶2
7. 从![]() 六种离子中选出适当的离子组成电解质,按下列要求进行电解:
六种离子中选出适当的离子组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则可选用的电解质溶液是_________。
(2)以碳棒为电极,使电解质质量不变,水量减少进行电解,则可选用的电解质溶液是_________。
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量都减少进行电解,则可选用的电解质溶液是_________。

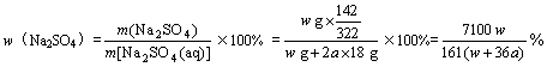

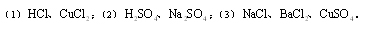
 。
。
 。
。
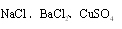 。
。