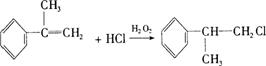
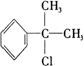
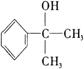
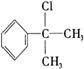
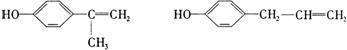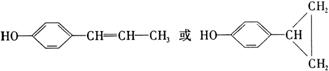写在前面的话 同学们,你们好! 欢迎你和我们一起进入高三化学专题复习! 我们将在今后的16周时间里对所学过的化学知识按化学基本概念、化学基本理论、元素化合物、有机化合物、化学实验、化学计算等内容分块复习。同时,我们还会根据复习的进度,及时提供一些优秀的高考模拟试题,供自我检测时使用。 本期我们提供了一些基础的检测试题,请你不借助任何参考书,认真作答,看看你能得多少分,以便于今后有的放矢地进行复习。 同学们,高三年级的学习生活充满紧张,也饱含期待。现在正当开学,你有没有做好准备,收拾行囊,全力以赴为实现自己的人生梦想而奋斗呢? 从今天开始,我们将和你同行! 高三化学开学检测 相对原子质量:H 第Ⅰ卷(选择题,共70分) 一、选择题(本题包括10小题,每小题3分,共30分,每小题只有一个选项符合题意) 1.下列各组物质的晶体,化学键类型相同,晶体类型也相同的是 A.
2.最近科学家发现了氧元素的一种新的粒子
A.它是氧元素的一种同素异形体 B.它是氧元素的一种同位素 C.它的摩尔质量为
3.下列物质加入水中,能使水的电离程度增大,且所得溶液显酸性的是 A.
4.下列现象或应用中,不涉及胶体性质的是 A.在饱和氯化铁溶液中逐滴加入NaOH溶液,产生红褐色沉淀 B.清晨,在茂密的树林中,常常可以看到从枝叶间透过的道道光柱 C.用半透膜分离淀粉和食盐的混合液 D.肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 5.氢气是人类最理想的能源。已知在 A.
B.
C.
D.
6.下列关于铜电极的叙述中正确的是 A.铜锌原电池中铜是负极 B.用电解法精炼粗铜时粗铜作阳极 C.在铁上电镀银时用铜作阴极 D.电解稀硫酸时用铜作阳极,阳极产物为氧气 7.目前,科学家拟合成一种“二重构造”的球形分子,即把足球型的
A.它是由两种单质组成的混合物 B.它是一种硅酸盐 C.它是一种新型化合物 D.它是一种高聚物 8.一定条件下,氨气与一氧化氮发生反应:
A.2 :3 B.3 : 9.下列有机物中,既能发生加成反应,又能发生酯化反应,还能被新制备的
A.
C.
10.下列除去杂质所用试剂或方法错误的是 A.除去
B.除去苯中溶有的少量苯酚:加入适量NaOH溶液,反应后分液 C.除去乙酸乙酯中混有的少量乙酸:加入乙醇并加热 D.除去
二、选择题(本题包括10小题,每小题4分,共40分,每小题只有一个选项符合题意) 11.
A.常温常压下, B. C.58.5gNaCl晶体中所含的氯化钠分子数目为
D.
12.t℃时,甲、乙两个烧杯中各盛有浓度相同、质量相等的不饱和的KCl溶液,一份蒸发掉m g水,冷却到原温度,析出a g晶体(不含结晶水);另一份蒸发掉n g水,冷却到原温度,拆出b g晶体。则t℃时KCl的溶解度是 A.
13.将
A.
C.
14.如图是元素周期表的一部分,关于元素X、Y、Z的叙述正确的是
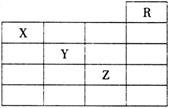
①X的气态氢化物与Y的最高价氧化物对应的水化物能发生反应生成盐 ②Y、Z的气态氢化物水溶液的酸性Y<Z ③Z的单质在常温下是液体,可与铁粉反应 ④Z的原子序数比Y大19 ⑤Z所在的周期中含有32种元素 A.①②③④ B.①②③④⑤ C.只有③ D.只有①④ 15.根据等电子原理,由短周期元素组成的粒子,只要其原子数相同,各原子的最外层电子数之和也相同,可互称为等电子体。等电子体之间结构相似、物理性质相近。以下各组粒子不能互称为等电子体的是 A.
16.下列离子方程式中书写正确的是 A.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液:
B.铁与稀硫酸反应:
C.向氯化铝溶液中加入过量的氨水:
D.碳酸氢按溶液中加入过量的氢氧化钠溶液:
17.将一定量Fe和
A.45mL B.50mL C.40mL D.无法确定 18.香兰素的结构简式如下图所示,它有宜人的气味,存在于香草豆、香脂、安息香、丁子油和香茅油中,是制作巧克力的辅助原料。下列关于香兰素的判断不正确的是
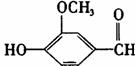
A.可与银氨溶液反应 B.可与氢氧化钠溶液反应 C.分子中所有原子都在同一平面上 D.可与浓溴水发生取代反应 19.用溶质的物质的量浓度均为
A.
20.有一瓶无色溶液,可能含有
A.肯定有
C.肯定有
第Ⅱ卷(非选择题,共80分) 注意事项: 1.用钢笔或圆珠笔将答案直接写在试卷中。 2.答卷前将密封线内的项目填写清楚。若填在线外,试卷作废。 3.本卷共7小题,共80分。 三、(本题包括2小题,共20分) 21.(8分)将
(1)达平衡时,
(2)若改变反应条件,在某条件下
①恒容条件下,升高温度 ②恒容条件下,降低温度 ③恒温条件下,缩小反应容器体积 ④恒温条件下,扩大反应容器体积 ⑤恒温、恒容条件下,加入适当催化剂 (3)若保持温度不变,在另一相同的 22.(12分)有A、B、C、D、E五种短周期元素,它们的原子序数依次增大。已知:A和C、B和D分别位于同主族,且B、D质子数之和是A、C质子数之和的2倍;E在同周期元素中原子半径最小。 (1)
(2)由A、B、C、D四种元素形成的两种化合物相互间反应的离子方程式为____________________________。 (3)A、B、C三种元素所形成的化合物的电子式为________。 (4)用多孔的石墨电极电解滴有酚酞的C和E形成的化合物的饱和溶液。接通电源一段时间后,________极(填电极名称)附近出现红色;另一极的电极反应式为________________,可用________检验该极所得产物。 四、(本题包括2小题,共22分) 23.(10分)A—J是中学化学常见的物质,它们之间的转化关系如下图所示(部分产物已略去)。已知A是一种高熔点物质,D是一种红棕色固体,H的焰色反应呈黄色。
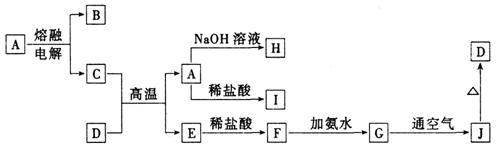
请回答了列问题: (1)A物质的化学式为________,H物质的名称为________________。 (2)G→J的化学方程式为________________。 (3)D物质与盐酸恰好反应的离子方程式为________________,所得溶液显酸性的原因是________________(用离子方程式表示)。 24.(12分)某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验。请回答:
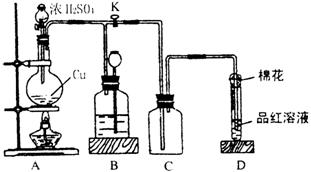
(1)装置A中发生的化学反应方程式为________________________。 (2)装置D中试管口放置的棉花中应浸一种液体,这种液体是___________________,其作用是________________________________________。 (3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由千余热的作用,A处仍有气体产生,此时B中现象是_______________________。B中应放置的液体是(填字母)________________。 a.水 b.酸性
(4)实验中,取一定质量的铜片和一定体积
①有一定量的余酸但未能使铜片完全溶解,你认为原因是_____________________。 ②下列药品中能用来证明反应结束后的烧瓶中确有余酸的是________________(填字母)。 a.铁粉 b.
五、(本题包括2小题,共24分) 25.(8分)已知某有机物的结构简式为:
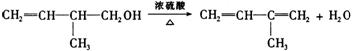
(1)该有机物中所含官能团的名称是_______________________________________。 (2)该有机物发生加成聚合反应后,所得产物的结构简式为_____________________。 (3)写出该有机物发生消去反应的化学方程式(注明反应条件): ____________________________________________________________________ 26.(16分)有机化学反应因反应条件不同,可生成不同的有机产品。例如: (1)
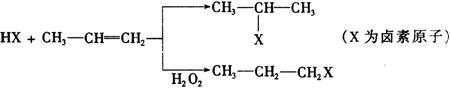
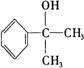
(2)苯的同系物与卤素单质混合,若在光照条件下,侧链上的氢原子被卤素原子取代;若在催化剂作用下,苯环上的氢原子被卤素原子取代。 工业上利用上述信息,按下列路线合成结构简式为
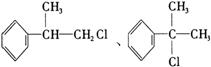
请根据上述路线,回答了列问题: (1)A的结构简式可能为________________________。 (2)反应①、③、⑤的反应类型分别为_________、_________、_________。 (3)反应④的化学方程式为(有机物写结构简式,并注明反应条件): __________________________________________________________。 (4)工业生产中,中间产物A须经反应③④⑤得D,而不采取直接转化为D的方法,其原因是_____________________________________________。 (5)这种香料具有多种同分异构体,其中某些物质有下列特征:①其水溶液遇
六、(本题包括1小题,共14分) 27.(14分)现有等物质的量的
(1)该混合物中
(2)如果反应后盐酸不足量,要计算生成
(3)若该混合物与盐酸恰好完全反应,则盐酸中HCl的物质的量浓度为多少?(请写出计算过程) (4)若
参考答案及评分标准 第Ⅰ卷(1—10题每小题3分,11—20题每小题4分,共70分) 1.D 2.B 3.B 4.A 5.C 6.B 7.C 8.A 9.D 10.C 11.B 12.A 13.B 14.A 15.D 16.C 17.C 18.C 19.B 20.D 第Ⅱ卷(共80分) 21.(共 8分)(l)(2分)0.05; (2)(2分)③⑤; (3)(4分)2b- 22.(共12分)(l)(l分)
(2)(2分)
(4)(1分)阴;(2分)
23.(共10分,每空2分)(l)
(2)
(3)
24.(共12分)(1)(2分)
(2)(每空1分)碱液(其他合理答案均可给分);吸收多余的二氧化硫,防止污染空气 (3)(每空2分)试剂瓶中液面下降,长颈漏斗中液面上升;d (4)(每空2分)①反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应 ②a、d 25.(共8分)(1)(各2分)碳碳双键、羟基; (2)(2分)
(3)(2分)
26.(共16分) (1)(各1分)
(2)(各2分)加成;消去;水解或取代 (3)(2分)
(4)(2分)
(5)(各2分)
(或
27.(共14分)(1)(2分)84 :100 (2)(每空2分)盐酸中HCl物质的量浓度;如果盐酸,不足量,应该以HCl的物质的量为计算标准,则必须知道盐酸中HCl的物质的量浓度。 (3)(4分)
(4)(4分)
|