2005-2006学年度综合练习(一) 理科综合能力测试-化学 第Ⅰ卷(选择题) 每小题6分。在每小题列出的四个选项中,选出符合题目要求的一项。以下数据可供解题时参考: 可能用到的相对原子质量: H 5.
A.
B.
C.
D.
6.电解质溶液的酸度(用AG表示)定义为
A.
C.
7.在下列数量含有10电子的物质中:①质量为 A.②>①>③>④ B.①>③>④>② C.④>②>①>③ D.①>④>③>② 8.在下列实验操作中,没有淡黄色沉淀生成的是 A.在5mL新制饱和氯水里滴入数滴饱和氢硫酸溶液 B.在5mL饱和氢硫酸溶液中,滴入数滴新制饱和氯水 C.在5mL饱和亚硫酸溶液中,滴入数滴新制饱和氢硫酸溶液 D.在5mL新制饱和亚硫酸溶液中,滴入数滴新制亚硫酸溶液 9.加工未完的精细钢件可浸入
A.
B.若除去水中溶解的等量氧气,消耗
C.
D.
10.将一定量Fe和
A.350mL B.400mL C.450mL D.500mL 11.下列实验操作正确的是 A.配制 B.测定硫酸铜晶体中结晶水含量时,须用小火缓慢加热,同时用玻璃棒轻轻搅拌硫酸铜晶体,防止晶体飞溅 C.为检验酸性溶液中的
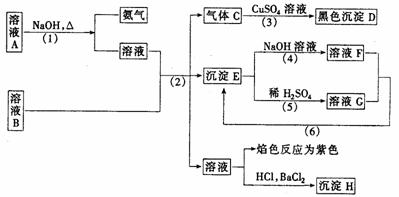
D.配制一定物质的量浓度的硫酸溶液时,应将量取好的浓硫酸先放火烧杯中,然后加水稀释 12.一定质量的铜和足量的硝酸反应,所放出的气体与标准状况下的氧气 A. 第Ⅱ卷(非选择题) 25.(18分)依据下列实验过程,写出(1)~(6)发生化学反应的离子方程式,并回答溶液A和溶液B的化学式。
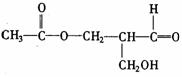
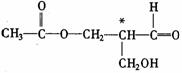
(1)__________________________________; (2)__________________________________; (3)____________________________________; (4)____________________________________; (5)____________________________________; (6)____________________________________; (7)溶液A是_________________; (8)溶液B是_________________。 26.(12分)在有机物分子中,碳原子所连的4个原子或原子团均不相同时,该碳原子叫不对称碳原子,以
(1)标出下列有机化合物中的不对称碳原子:
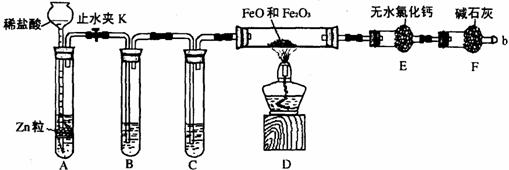
(2)欲使上述有机物通过化学变化,使生成物不具有光学活性,这些化学反应的类型有:(可不填满也可补充) ①___________________________ ②___________________________ ③___________________________ ④___________________________ ⑤___________________________ ⑥___________________________ 27.(18分)实验室可用下列实验装置测定FeO和
(1)实验前如何检查装置A的气密性__________________________________________;对A中所发生的反应,有时要向其中加入少量硫酸铜溶液,目的是____________________。 (2)为了安全,在点燃酒精灯之前,在F装置出口b处必须_______________________,实验开始后,在b处必须___________________________。 (3)装置C中所放试剂为浓硫酸,则装置B的作用是___________________________。 (4)干燥管E右边又连接干燥管F的目的是___________________________。若无干燥管F,测得
(5)若FeO和
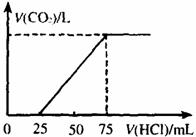
28.(12分)有10mL NaOH溶液,向其中通入一定量的
请回答下列问题: (1)向
(2)混合溶液中
(3)原NaOH溶液中NaOH的物质的量浓度为___________,所通
(4)a mL同浓度的NaOH溶液,与足量的
参考答案: 5.C 6.B 7.A。NH3、HF、H2O、CH4的分子中均含有10个质子, 8.A。在Cl2过量的条件下,H2S可被Cl2氧化为H2SO4,没有淡黄色沉淀生成,化学方程式为:
9.C。
10.B。 11.B 12.C 25.(18分) (1)
(2)
(3)
(4)
(5)
(6)
(7)溶液A为(NH4)2S (8)溶液B为KAl(SO4)2 26.(12分) (1)
(2)①加成反应,使
②氧化反应。将
③酯化反应。 ④水解反应。 ⑤消去反应。 27.(共18分)(1)关闭止水夹K,从长颈漏斗向试管内加水,至长颈漏斗中管内的液面高于管外液面,静置一段时间,若液面高度差不发生变化,则气密性好(3分);加快氢气产生的速率(2分)。 (2)检验氢气的纯度(2分);点燃未反应的氢气(2分)。 (3)除去氢气中混有的氯化氢气体(2分)。 (4)防止空气中的水蒸气进入干燥管E中(2分);偏大(2分)。 (5)
28.(共12分)(1)
(2)1 :1(2分) (3)0.75mol/L(2分);112mL(或 (4) |