2006年高考化学复习建议
复习高中化学要按照知识结构,着力揭示知识间的内在联系和规律性,紧密联系实际,培养运用知识解决实际问题的能力。
一、 运用规律 编织网络
1.运用元素周期律,把握非金属全局
氧化区非金属元素 F、O、Cl、Br;
还原区非金属元素 H、B、C、Si、P、As;
氧化还原区非金属元素 N、S、Se、Te、I、(At)。
2.运用金属活动性顺序,把握金属全局
活泼金属组 K、Ca、Na,Mg,Al;
中活泼金属组 Zn,Fe,Sn,Pb,(H);
不活泼金属组 Cu,Hg,Ag,Pt,Au。
二、 把握重点 联系实际
1.联系环境保护实际
例 汽车尾气中是空气的重要污染源,油、气混合气点火爆发时产生的SO2、NO、CO、C等随尾气排出污染大气。为简化讨论可设汽油主要成分为C8H18,空气中O2的体积分数为20%。
(1)简析空气污染物产生的原因
(2)消除汽车尾气对环境污染的方法和途径。
2.联系生活实际
例1 氯气作为饮用水消毒剂已有百余年历史。
(1)简析Cl2消毒原理
(2)Cl2作为饮用水消毒的弊病
(3)ClO2作为新型饮用水消毒剂的优点,简述ClO2的生产原理。
提示:
(1) ![]()
![]()
![]() ,
, ![]() 具有强氧化性可以消毒杀菌。残氯可用绿矾除去,
具有强氧化性可以消毒杀菌。残氯可用绿矾除去, ![]() 。
。 ![]() 水解生成
水解生成 ![]() 胶体,可与泥土胶体凝聚。
胶体,可与泥土胶体凝聚。
(2) ![]() 与水中有机物生成有机氯代物,于人有害。
与水中有机物生成有机氯代物,于人有害。
(3) ![]() 氧化性比
氧化性比 ![]() 更强,且不会生成有机氯代物。
更强,且不会生成有机氯代物。
![]()
![]()
例2 2002年9月国家质检总局严令禁止用“雕白粉”作为食品添加剂,10月进行严厉查处。雕白粉可使食品增白,增加韧性,改善口感,但食用后会引起中毒,伤害肝、肾,危害极大。
雕白粉又称“吊白块”,化学名称叫次硫酸氢钠甲醛,可由甲醛与次硫酸氢钠反应制得:
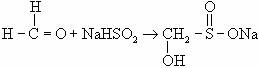
![]() 是一个离子化合物,可表示为
是一个离子化合物,可表示为 ![]() 。
。
(1)雕白粉的溶解性。
(2) ![]() 与NaOH溶液反应的离子方程式。
与NaOH溶液反应的离子方程式。
(3)甲醛与 ![]() 的反应实质和反应类型。
的反应实质和反应类型。
(4)甲醛变为聚甲醛的化学方程式及反应类型。
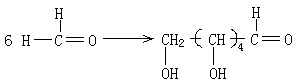
(5)甲醛在弱碱性条件下生成已醛糖的反应实质。
提示:
(1)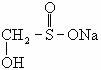 有亲水的-OH和钠盐结构,易溶于水。
有亲水的-OH和钠盐结构,易溶于水。
(2) ![]()
(3) 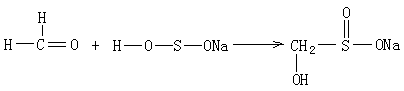
(4) ![]()
(5) 
3.联系生产实际
例1 从资料查得KMnO4的如下制法:第一步将MnO2与KOH混合,在空气中灼热并不断搅拌制得K2MnO4;第二步将K2MnO4的浓溶液进行电解,阳极可得KMnO4。
(1)K2MnO4的生成原理
(2)电解制KMnO4的电极反应及电解总反应方程式。
例2 1862年索尔维在氨化饱和食盐水通入 ![]() 制得
制得 ![]() ,将
,将 ![]() 在
在
250℃焙烧可得 ![]() ,另一产物
,另一产物 ![]() 循环使用;析出
循环使用;析出 ![]() 的母液加入生石灰后加热,回收氨并循环利用。这就是索尔维制碱法。
的母液加入生石灰后加热,回收氨并循环利用。这就是索尔维制碱法。
(1)简析索尔维制碱法原理,写出相关反应方程式。
(2)我国化学家侯德榜揭示了索尔维制碱法技术秘密,并创立了举世闻名的侯氏制碱法,其主要之点在于把析出 ![]() 晶体的母液里加入
晶体的母液里加入 ![]() ,使
,使 ![]() 析出,所得饱和食盐水循环利用。把合成氨与纯碱生产结合为一体。简析侯氏制碱法优点。
析出,所得饱和食盐水循环利用。把合成氨与纯碱生产结合为一体。简析侯氏制碱法优点。
提示:
(1) ![]() 是强酸强碱盐,二氧化碳是弱酸的酸酐,两者之间不能发生化学反应,先通入
是强酸强碱盐,二氧化碳是弱酸的酸酐,两者之间不能发生化学反应,先通入 ![]() ,再通入
,再通入 ![]() 时,发生以下反应:
时,发生以下反应:
![]()
![]()
把 ![]() 与
与 ![]() 不能发生的反应,转变为两盐间(
不能发生的反应,转变为两盐间( ![]() 与
与 ![]() )的复分解反应,生成
)的复分解反应,生成 ![]() ,另有
,另有 ![]() 生成。
生成。
析出 ![]() 后的母液是
后的母液是 ![]() 溶液,当加入生石灰发生的化学反应为:
溶液,当加入生石灰发生的化学反应为:
![]()
![]()
![]()
(2)侯氏制碱法节约了一种原料CaO,少产生一种工业废物 ![]() ,多生产一种产品
,多生产一种产品 ![]() ,使食盐的利用率由60%上升至90%以上,使原料中的各原子均得到充分有效的利用。侯氏制碱法可称为绿色化学的先驱与典范。
,使食盐的利用率由60%上升至90%以上,使原料中的各原子均得到充分有效的利用。侯氏制碱法可称为绿色化学的先驱与典范。
例3 含有 ![]() 酸性工业废水需经处理才能排放。从资料查得:在此工业废水中加入适量
酸性工业废水需经处理才能排放。从资料查得:在此工业废水中加入适量 ![]() ,以Fe为电极进行电解,经一系列变化,
,以Fe为电极进行电解,经一系列变化, ![]() 变为
变为 ![]() 沉淀,另有
沉淀,另有 ![]() 沉淀同时生成,且废水变为中性,可以排放。
沉淀同时生成,且废水变为中性,可以排放。
(1)简析电解除铬的化学原理。
(2)加入 ![]() 的作用。能否用石墨电极来代替铁电极实现电解除铬,说明其原因。
的作用。能否用石墨电极来代替铁电极实现电解除铬,说明其原因。
提示:通电时两极反应为:
阳极 ![]()
阴极 ![]()
![]() 与
与 ![]() 在酸性条件下发生氧化还原反应
在酸性条件下发生氧化还原反应
![]()
![]() 与阴极产生的
与阴极产生的 ![]() 结合为
结合为 ![]() 沉淀
沉淀
![]()
![]()
4.联系大自然实际
例 从矿物学的资料查得:当胆矾溶液渗入地下,遇黄铁矿(FeS2)时,会生成辉铜矿(Cu2S),另有FeSO4与H2SO4生成。
(1)配平上述反应的化学方程式
(2)分析上述反应的氧化剂、还原剂。
(3)氧化产物与还原产物的物质的量之比。
(4)简析矿物共生问题。
提示:![]() 的比值为14∶5)
的比值为14∶5)
![]()
有 ![]() 氧化
氧化 ![]() 的反应,另有
的反应,另有 ![]() 的自身氧化还原反应,氧化产物是
的自身氧化还原反应,氧化产物是 ![]() ,还原产物
,还原产物 ![]() ,其物质的量之比为3∶7。
,其物质的量之比为3∶7。
5.联系前沿科学实际
例1 氢硼化钠(NaBH4)是一种离子化合物,具有极强的还原性,被称为万能还原剂,在化学工业有着广泛的应用。
(1)在NaBH4中的阴离子是______,氢元素的化合价是______。
(2)将NaBH4放入水中迅速生成生成偏硼酸钠和氢气,这个反应的氧化剂是_____,还原剂是_____,氧化产物是_____,还原产物是_____。
(3)在工业上,NaBH4可用于精细有机合成,还可用于含有Au3+的废液中回收黄金,表示这个反应的离子方程式是______________________________。
例2 氢镍电池是近年来开发的新型化学电源(碱性电池)。电极反应如下:
H2 + 2NiO (OH ) ![]() 2Ni
(OH )2
2Ni
(OH )2
(1)放电时两极的电极反应为:______________________________。
(2)充电时两极的电极反应为:______________________________。
提示:
放电:
(-)极 ![]()
(+)极 ![]()
充电:
阴极 ![]()
阳极 ![]()
例3 燃料电池是当今科学研究的重点课题。燃料电池的基本原理是将燃料从电极负极通入,氧气(空气)从电源正极通入,以KOH为电解质溶液,负极发生氧化反应,正极发生还原反应,化学能转变为电能。
(1)写出H2、O2燃料电池的电极反应。
(2)写出CH4、O2燃料电池的电极反应。
例4 寒痛乐热敷袋可治疗关节炎和腰腿疼痛,深受老年患者欢迎。查得:寒痛乐原料有铁粉、木屑、炭粉、食盐及少量水。将其置于布袋内,并加塑料袋密封。使用时,打开塑料袋取出布袋,轻摇片刻,温度可达50℃左右,置于病痛部位,可持续保温24小时。使用完毕,打开布袋,可见有棕红色粉末生成。简要回答以下各问:
(1)简述热敷袋的化学原理。
(2)药粉需放置布袋内的原因,布袋又必须置密封塑料袋内的原因。
(3)药品中的食盐及木屑的作用。
三、重视实验 多思创新
1.运用概念、理论和规律 正确分析给出的实验现象
例1 在FeCl2 aq中滴入浓溴水,溶液变为橙黄色,其原因是______________________,能证实上述判断的实验操作是______________________。
例2 将FeCl3 aq均分为两等份,一份加入3~4滴12 ![]() 盐酸,另一份加入3~4滴蒸馏水,可观察到的现象变化是______________,在两只试管中均加入过量Mg,可观察到的现象变化是______________,其原因是______________。
盐酸,另一份加入3~4滴蒸馏水,可观察到的现象变化是______________,在两只试管中均加入过量Mg,可观察到的现象变化是______________,其原因是______________。
例3 取 ![]() 少许滴加饱和氯水,可发生阴离子置换,当
少许滴加饱和氯水,可发生阴离子置换,当 ![]() 过量时,
过量时, ![]() 可把
可把 ![]() 氧化为
氧化为 ![]() ,
, ![]() 是一个有光泽的无色晶体,极易溶于水。
是一个有光泽的无色晶体,极易溶于水。
用试管取约5mL含有 ![]() 的无色溶液,加入
的无色溶液,加入 ![]() ,滴加饱和氯水,振荡,静置,可见
,滴加饱和氯水,振荡,静置,可见 ![]() 层变为紫色,继续滴加饱和氯水,
层变为紫色,继续滴加饱和氯水, ![]() 液层变为无色;再滴加饱和氯水,
液层变为无色;再滴加饱和氯水, ![]() 层又呈现橙红色。
层又呈现橙红色。
(1) ![]() 层呈现紫色的原因
层呈现紫色的原因
(2) ![]() 层变为无色的原因是
层变为无色的原因是
(3) ![]() 层变为橙红色的原因是
层变为橙红色的原因是
(4)在上述三个化学反应的还原剂是 ,这些还原剂的还原性由强渐弱的顺序是 。
2.独立操作 设计实验
例1 实验室制HCl,可用固热加热制气装置制备,写出这一反应的化学方程式:
________________________。
能否运用固-液常温制气装置制取干燥的氯化氢气体(药品可任意选择)。
____________。
例2 过碳酸钠( ![]() )跟稀硫酸反应的化学方程式如下:
)跟稀硫酸反应的化学方程式如下:
![]()
现有如下装置可供选择:
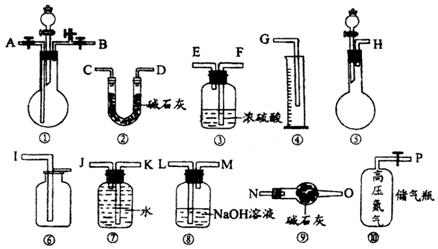
(1)当含有 ![]() 杂质时应选用的仪器为:
杂质时应选用的仪器为:
(2)当含有 ![]() 杂质时应选用的仪器为:
杂质时应选用的仪器为:
提示:
(1)若过碳酸钠中含有少量 ![]() ,应选用的仪器代号是③⑧⑦④,连接顺序是H-L-M-J-K-G。
,应选用的仪器代号是③⑧⑦④,连接顺序是H-L-M-J-K-G。
(2)另一过碳酸钠中含有 ![]() ,此时应选用仪器是⑩①③②⑨,连接顺序是P-A-B-F-E-C-D-N-O
,此时应选用仪器是⑩①③②⑨,连接顺序是P-A-B-F-E-C-D-N-O