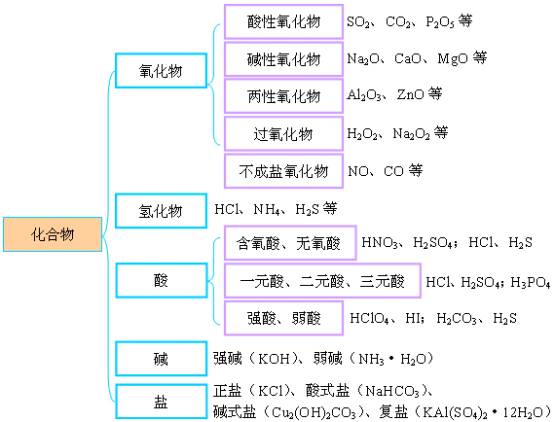
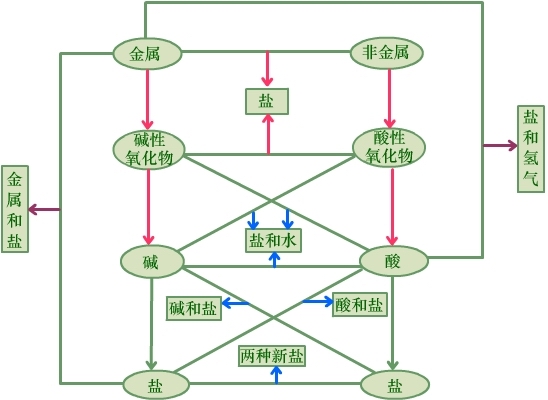
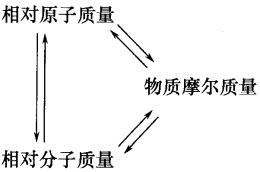
化学基本概念是化学科学领域最基本的学科语言表达单位,是掌握化学科学的基础,是形成化学科学思维的重要基础。 复习化学的基本概念,要注意抓好概念的准确性,系统性和灵活性。准确性是指对概念的深刻理解;系统性是指相关概念间的联系,形成概念网络;灵活性是指运用概念和概念网络分析解决实际问题。 比如:电解质的概念是:凡是在水溶液里或熔化状态下能够导电的化合物。这一电解质定义言简意赅,每一字词的选用都有特定的含义。“水熔液里或熔化状态下”讲的是电解质导电的外部条件,“或”字说明两个条件居一便可,“能够导电”讲的是电解质的性质,“化合物”则是指电解质的物质分类。在完整理解了上述三层含义以后,还要注意“三个区分”和“一个本质差异”。这三个区分是:要把强电解质和弱电解质区别开来;把化合物溶于水与化合物跟水发生化学反应生成新化合物区别开来;把电解质(酸、碱、盐等化合物)与电解质溶液(酸、碱、盐的水溶液,属于混合物)区别开来。一个本质差异是:金属导电是物理变化,电解质及其溶液的导电是化学变化。做到了以上各点,才有对电解质概念的深刻理解,才能正确回答有关电解质概念的各种问题。 又比如:从电解质概念出发,探索电解质水溶液导电的原因,引出在电解质溶液里存在自由水合离子这一本质特征,建立电解质电离的概念;从多种不同电解质溶液导电能力不同这一事实出发,建立起强弱电解质的概念;从研究电解质溶液导电实质,是在直流电的作用下,在两个电极上发生的氧化还原反应,建立起电解的概念;从研究不同条件下的电解,又导出了电镀、电精炼和电冶炼。在进行总复习时,就要有意识的把电解质、电离、电离平衡、强弱电解质、电解、电镀、电精炼、电冶炼等一系列基本概念放在一起,联成一线,系统地、准确地掌握好这些相关的基本概念。 再比如:在复习阿伏加德罗定律时,不仅要理解“同温同压下相同体积的气体含有相同的分子数”这一定律的含义,还要进而思考同温同压下,不同体积的气体与分子数的关系,从而引出阿伏加德罗定律的重要推论:同温同压下不同体积的气体,它们的气体体积之比,等于气体分子数之比,即等于气体的物质的量之比。同时,还能推出,同温同体积的气体,气体的压强之比,等于气体分子的个数之比,即等于气体的物质的量之比。还要能够运用阿伏加德罗定律的这些推论,确定气体的分子组成和用于有气体参加反应或有气体生成的化学计算,才算真正掌握了阿伏加德罗定律。 复习基本概念的重点 复习基本概念不要贪多求全,面面俱到,应该抓准重点,确保落实。 复习基本概念应抓的重点为:(1)离子反应规律(2)氧化还原反应(3)掌握以物质的量为中心的化学常用计量等。 1.物质的组成 从宏观上看,物质由元素组成;从微观上看,物质由原子、分子、离子构成(见下图)。 2.物质的性质 3.物质的分类 纯净物分为单质和化合物。 4.各类物质间的相互关系 单质、氧化物、酸、碱、盐等各类物质间的关系,要先抓好纵向关系: 在抓好上述两条纵向关系的基础上,抓好各物质间的横向联系,便可得到各类物质的相互关系图:
1.溶液 溶质分散在溶剂中形成的均一、稳定、透明的混合物。溶质可以是分子或离子,溶质的直径小于 2.胶体 胶粒分散在分散剂中形成的均一稳定透明的混合物,胶粒可以是高分子或小分子聚集体,微粒直径在
|