化学基础理论(上)——考点网络
| 化学基础理论(上) |
物质结构 |
掌握原子序数、核电荷数、质子数、中子数、核外电子数以及质量数与质子数、中子数间关系 |
| 了解短周期元素的原子核及电子排布规律 |
| 理解离子键、共价键、极性键、非极性键,了解极性分子、非极性分子、分子间作用力 |
| 了解几种晶体类型及其重要性质 |
| 元素周期律和元素周期表 |
掌握元素周期律的实质,了解周期表结构 |
| 以第三周期为例,掌握同一周期内元素性质的递变规律与原子结构之间的相互关系 |
| 以ⅠA、ⅦA为例,掌握同一主族元素性质的相似性和递变规律及其与原子结构的关系 |
物质结构、元素周期律、化学平衡、电解质溶液理论,是高中化学的四根主要支柱。是化学学科领域最基本的学科原理和规律,复习基本理论,要努力做到理解化学原理和规律,并对其进行融会贯通,统摄整理,使之系统化、网络化、有序地储存,并能正确描述、辨认、综合运用解决问题。
一、物质结构

1.原子的组成与结构

质子数=核电荷数=核外电子数=原子序数
质量数(A)=质子数(Z)+中子数(N)
元素的相对原子质量=∑同位素相对原子质量×同位素原子个数百分比
2.化学键与分子结构
化学键:相邻的原子之间强烈的相互作用叫做化学键。化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。


二、元素周期律和元素周期表
1.元素周期律和元素周期表
元素的性质随着原子序数的递增而呈周期性的变化,这个规律叫做元素周期律。
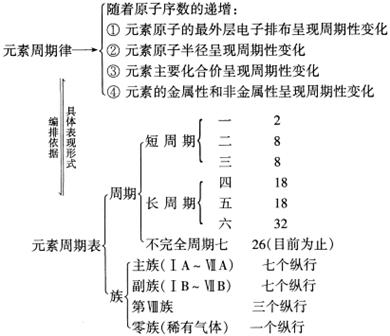
2.元素在周期表中的位置、元素原子结构、元素性质的关系

3.元素金属性和非金属性强弱实验标志
(1)金属性强弱实验标志:与水或酸反应置换氢的难易;最高价氧化物的水化物碱性强弱;单质的还原性强弱;对应离子的氧化性强弱(例外);相互置换反应;原电池反应中正负极。
(2)非金属强弱的实验标志:与氢气化合的难易及气态氢化物的稳定性;最高价氧化物的水化物酸性强弱;相互置换反应;单质的氧化性强弱;简单离子的还原性强弱。 