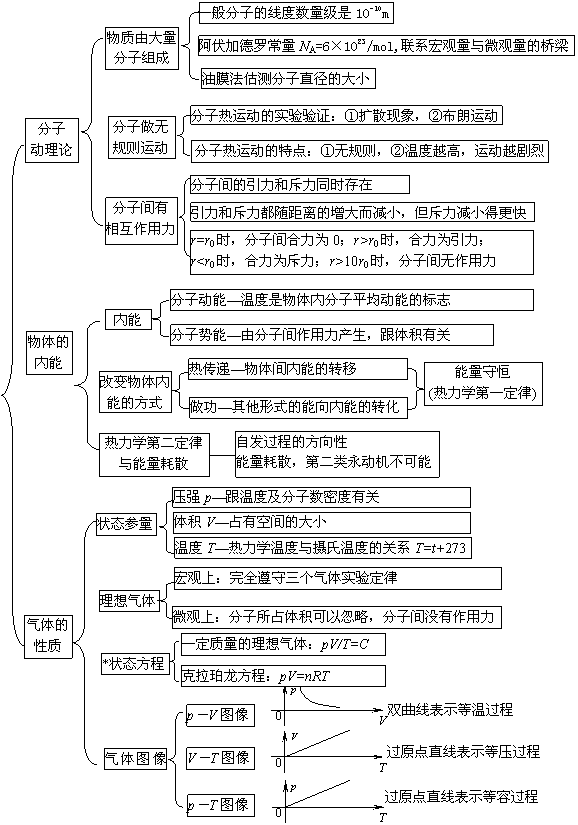
知识结构 方法指导
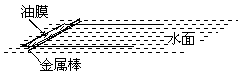
热学,从宏观上讲,是研究与温度有关的物理现象;从微观上讲,是研究由大量微观粒子组成的系统的性质. 下面几个问题是这部分的重点和难点: 1、计算有关的微观量 (1)利用油膜法测定分子的大小是课本上要求的内容,应该掌握其原理和方法:把一滴油酸滴到水面上,让油膜尽量散开,当它的面积最大时,即认为油膜是由单层分子排布的,测出一滴油的体积V,油膜的最大面积S,把分子看作球形,则直径d=V/S. 关键是如何测出一滴油的体积V及油膜的最大面积S.测量一滴油的体积可用累积法,一般先配好一定浓度的油酸酒精溶液,用滴管往量筒中滴油酸溶液,数出滴入的滴数n,再量出这n滴溶液的总体积V总,则每滴溶液的体积V=V总/n,再根据溶液的浓度即可算出每滴溶液中含有的油酸体积. 测量油膜的最大面积S,可有两个方法:一是课本实验中采用的方法,即在一个浅盘里倒入一些水,在水面上滴入一滴油酸的酒精溶液,待酒精挥发后,水面上即形成一层单分子油膜,在清高盘上盖一块玻璃板,在玻璃板上描出油膜的形状,再把玻璃板放到方格纸上,数出画出的曲线所围的面积,即为油膜的面积.另一种方法是可以在水面上放置一个U形的金属杆制成的框架,框架上放置另一根金属棒,如图所示,开始时把金属棒靠近左端,把油滴滴在金属框架内,油膜将充满整个框架内部,再缓慢向右拉动金属棒,直到油膜发生破裂,记下临破裂时的位置,即可测出油膜的最大面积S. (2)利用阿伏加德罗常量计算有关的微观量.阿伏加德罗常量NA=6×1023/mol,它是联系宏观量与微观量的桥梁.微观量,指分子体积、分子质量等无法直接测量的量,只要我们测出物质的摩尔质量M、摩尔体积Vm等,即可利用阿伏加德罗常量计算分子的质量m = M/NA,分子所占的体积V= Vm/ NA.对于分子所占的体积,有必要加以说明:对于固体和液体,由于分子间距离较小,粗略地看,可以认为各分子间是紧密排列的,这时分子所占的体积就可以近似认为是分子体积;对于气体,由于分子间距离很大,而分子本身的体积相比较是很小的,分子所占的体积决不能说是分子体积. 把分子看作小球,是一种简化处理问题的方法,是一种模型.如果要求估算固体或液体分子小球的直径,可以直接把一个分子所占的体积V开三次方即可,即
2、涉及内能的能量守恒定律及能量转化方向问题 涉及到内能的能量守恒定律,称为热力学第一定律,对一个系统来说,外力对它做的功W以及外界向它传的热Q之和,等于系统内能的增量ΔEk,即W+Q=ΔEk. 该定律是对改变物体内能的两种方式(热传递及做功)的定量表述,它实质上就是能量守恒定律,外界对物体做功W,并向物体传递热量Q,物体的内能增加了ΔEk,同时外界必然要消耗能量W,并且减少内能Q,自然界的总能量仍是保持不变的. 自然界涉及到内能的各种问题中,能量的转化、自然界自发过程都有一定的方向性,这就是热力学第二定律的内容.热力学第二定律有多种不同的表述方式,例如热量总是自发地从高温物体传向低温物体;机械能可以完全转化这内能,而内能却不可能完全转化这机械能,等等.热力学第二定律指出了能量耗散的道理,明确了第二类永动机是不可能存在的. 3、气体变化的微观解释 气体的压强是大量分子对器壁碰撞的结果,从微观上讲,影响气体压强的因素有两个,一个是分子数密度的大小,另一个是分子平均动能的大小.对一定质量的气体而言,前者与气体体积大小有关,后者则完全由温度决定. 一定质量的理想气体,在保持温度不变时,分子的平均动能不变.当它的体积变大时,虽然单个分子对器壁的碰撞作用力保持不变,但分子的数密度由于体积变大而减小,单位时间内对同一块器壁的碰撞次数减少,因此气体的压强变小. 一定质量的理想气体,在保持体积不变时,分子数密度保持不变,当它的温度升高时,分子的平均动能变大,分子在与器壁发生碰撞时对器壁产生的作用力变大,因此气体的压强变大. 一定质量的理想气体,在保持压强不变时,当它的温度升高时,分子的平均动能变大,单个分子对器壁的碰撞作用力变大,只有体积适当变大,分子数密度适当变小,气体的压强才可能保持不变. 以上是定性的解释.具体定量的关系则是一定质量理想气体的状态方程,即 |