|
 |
 |
||
 |
|||
|
|
|
镁在空气中燃烧 |
铁丝在氧气中燃烧 |
||
|
从左到右:镁、锌、铁、铜 |
|
|
|
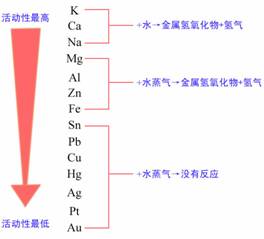 |
 |
||
|
|
趣味实验:熔化的铝为什么不能滴下? |
||
趣味实验:毛刷实验——观察铝与氧气的快速反应 |
||
|
|
 |
 |
||
 |
|||
|
|
|
镁在空气中燃烧 |
铁丝在氧气中燃烧 |
||
|
从左到右:镁、锌、铁、铜 |
|
|
|
 |
 |
||
|
|
趣味实验:熔化的铝为什么不能滴下? |
||
趣味实验:毛刷实验——观察铝与氧气的快速反应 |
||
|