知识要点
第一章 氮族元素
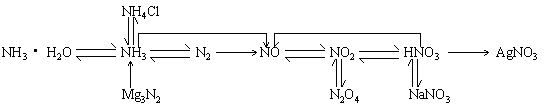
1.氮气:
(1)结构:电子式:![]() 结构式:
结构式:![]()
(2)化学性质:
a. 氧化性:跟H2、Mg反应。
b. 还原性:跟O2、CuO、Cl2等氧化剂反应。
2.氮的氧化物:N2、NO、N2O3、NO2、N2O4、N2O5
NO与NO2的比较
物质 |
NO |
NO2 |
物理性质 |
无色,不溶于水,有毒 |
红棕色,溶于水,有刺激性气味、有毒 |
化学性质 |
还原性:2NO+O2===2NO2 |
3NO2+H2O===2HNO3+NO |
3.氨、氨水、铵盐:
氨和铵的比较
名称 |
氨 |
铵 |
符号 |
NH3 |
NH4+ |
结构式 |
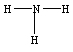 |
 |
构成微粒 |
氢、氮原子 |
氮和氢构成的离子 |
电性 |
电中性 |
带一个单位正电荷 |
空间构型 |
三角锥形 |
正四面体 |
化学键 |
极性键 |
极性键和配位键 |
键角 |
||
联系 |
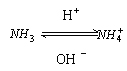 |
|
4.硝酸:
(1)强酸性:HNO3![]() H++NO3+有酸的通性。
H++NO3+有酸的通性。
(2)强氧化性:跟金属(除Au、Pt)反应;跟非金属C、S、P等反应;氧化其它物质,如:H2S、HI、HBr、Fe2+橡胶等。
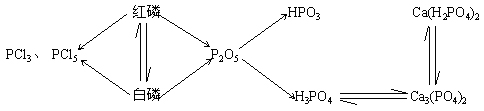
5.磷、磷酸:
(1)同素异形体:红磷、白磷;O2、O3;金刚石、石墨、无定型碳、C60。
(2)红磷、白磷的物理性质和化学性质。
(3)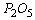 :
: ![]() (偏磷酸,剧毒),
(偏磷酸,剧毒), ![]() (磷酸,无毒)
(磷酸,无毒)
(4)磷酸: 三元酸,可生成三种盐:
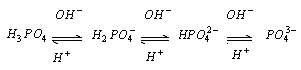
第二章 化学平衡
1.化学平衡的建立
以可逆反应![]() 为例,若开始只有反应物,没有生成物,此时A和B的浓度最大,因而正反应速率最大;而C和D初始浓度为0,因而逆反应速率为0。随着反应的进行,反应物不断减少,生成物不断增多,
为例,若开始只有反应物,没有生成物,此时A和B的浓度最大,因而正反应速率最大;而C和D初始浓度为0,因而逆反应速率为0。随着反应的进行,反应物不断减少,生成物不断增多,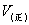 越来越小,
越来越小,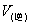 越来越大,反应进行到某一时刻,
越来越大,反应进行到某一时刻,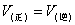 ,这时就达到了化学平衡,此时反应中的各物质浓度不变,但反应并未停止,只是单位时间内各物质生成的数量等于消耗的数量,从外观上没有变化,但反应一直进行,如图2-2-1所示。
,这时就达到了化学平衡,此时反应中的各物质浓度不变,但反应并未停止,只是单位时间内各物质生成的数量等于消耗的数量,从外观上没有变化,但反应一直进行,如图2-2-1所示。
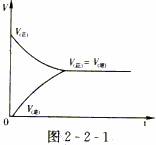
若开始只有生成物,没有反应物,同理可用正反应速率和逆反应速率的变化来说明上述反应平衡的建立,如图2-2-2所示。
2.化学平衡状态
①定义:化学平衡状态是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
②前提:一定条件(温度、浓度、压强等),某一化学平衡是在一定条件下建立的,当条件改变了化学平衡就被破坏了。
③根本原因、实质:![]() ,同一物质在正反应和逆反应中的速率相等,即生成和消耗的速率相等。
,同一物质在正反应和逆反应中的速率相等,即生成和消耗的速率相等。
![]() 是指同一物质在正反应和逆反应中的速率,即同一物质生成和消耗的速率相等。如A消耗速率=A生成速率,反应达到了化学平衡。不同物质的正、逆反应速率并非绝对没有可比性,它们经比例转化后相等也可。
是指同一物质在正反应和逆反应中的速率,即同一物质生成和消耗的速率相等。如A消耗速率=A生成速率,反应达到了化学平衡。不同物质的正、逆反应速率并非绝对没有可比性,它们经比例转化后相等也可。
以可逆反应![]() 为例,当达到化学平衡时,
为例,当达到化学平衡时,
![]() ,
,![]()
④标志:各组分的浓度保持不变。
浓度包括:物质的量浓度、质量分数、物质的量分数、气体体积分数等。
⑤化学平衡的特征:“动、定、变”。
动:化学平衡是动态平衡。当一个反应达到化学平衡,反应并未结束停止,![]() 。
。
定:各组分的浓度保持不变.浓度保持不变并非各成分含量相等。
变:外界条件改变,则正、逆反应速率不再相等,原化学平衡被破坏,各组成的含量改变。
所以某一化学平衡状态肯定与某一确定的条件相联系.当条件一定时,可逆反应无论从正反应开始,还是从逆反应开始,最后都能达到同样的化学平衡。条件改变原化学平衡就被破坏。
3.化学平衡常数
对于一般的可逆反应![]() ,当在一定温度下达到化学平衡时,这个反应的平衡常数
,当在一定温度下达到化学平衡时,这个反应的平衡常数
![]()
从平衡常数K的大小,可以推断反应进行的程度。平衡常数K越大,反应进行的程度越大,反应物的转化率也越大;K越小,反应进行的程度越小,反应物的转化率也越小。温度一定时,K为一定值。K随温度的改变而改变,K不随反应物或生成物浓度的改变而改变。
使用平衡常数时,必须注意是在哪一温度下进行的可逆反应。
转化率是对反应物而言的,可用来衡量反应进行的程度。
转化率=(起始量-平衡量)/起始量×100%
产率是对生成物而言的。产率=实际产量/理论产量×100%
说明:转化率和产率中的量是笼统的,可以是物质的量,也可以是物质的量浓度、质量、气体体积等。
4.判断可逆反应达到平衡的标志:
①正反应速率等于逆反应速率。
②各物质的浓度保持不变,包括:各物质的物质的量浓度、质量分数、物质的量分数、气体体积分数等。
第三章 电离平衡
1.强电解质和弱电解质
根据电解质在水溶液里电离能力的大小又可将电解质分为强电解质和弱电解质。能完全电离的电解质叫做强电解质,如强酸、强碱和绝大多数盐,其电离方程式用“![]() ”表示,例如:HCl
”表示,例如:HCl![]() H++Cl-,NaOH
H++Cl-,NaOH![]() Na++OH-。只能部分电离的电解质叫做弱电解质,如弱酸、弱碱等。其电离过程可逆,故电离方程式用“
Na++OH-。只能部分电离的电解质叫做弱电解质,如弱酸、弱碱等。其电离过程可逆,故电离方程式用“![]() ”表示。例如:CH3COOH
”表示。例如:CH3COOH![]() CH3COO-+H+,
CH3COO-+H+,![]()
弱电解质在水溶液中发生电离的“部分”大小是有差异的,这体现了弱电解质的相对强弱,可用特定的方法定量地表示不同弱电解质在相同条件下的电离程度的差异。
2.弱电解质电离平衡的实质
溶液中弱电解质的电离和离子的重新结合这两种过程是同时存在的(可逆反应),在一定条件下,当两者的速率相等时,就达到了平衡状态,这称为电离平衡。
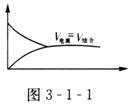
平衡时,溶液里离子的浓度和分子浓度都保持不变。如:氨水中存在着平衡:
![]() ,溶液中既有离子,又有电解质分子存在,而且溶液中
,溶液中既有离子,又有电解质分子存在,而且溶液中![]() 保持不变。
保持不变。
电离平衡是相对的、有条件的,当外界条件改变时,平衡就会发生移动。
3.影响弱电解质电离程度大小的因素
决定因素:弱电解质的相对强弱。
弱电解质的相对强弱![]() 电离度的大小。
电离度的大小。
弱电解质的相对强弱与弱电解质分子结构有关,取决于其分子中共价键的极性强弱,是该电解质分子和“本性”。
影响因素:
(1)浓度的影响:同一弱电解质,通常是溶液越稀,电离度越大。
(2)温度的影响:升高温度,电解质的电离程度增大。
(3)外加试剂的影响:外加试剂改变了溶液中离子的浓度,也会对电离平衡有所影响。
4.弱电解质电离程度大小的表示方法——电离平衡常数
与化学平衡一样,在一定条件下,弱电解质的电离达到平衡时,溶液中各组分浓度之间也存在着一定的关系,可以用电离常数来表示。
对于反应AB![]() A++B-,
A++B-,![]() 。K值越大,表示该电解质电离程度越大,所以可以用K的大小来判断弱电解质的相对强弱。
。K值越大,表示该电解质电离程度越大,所以可以用K的大小来判断弱电解质的相对强弱。
电离平衡常数与化学平衡常数一样,只受温度的影响;电离常数越大,表示该弱电解质的电离程度越大,电离能力越强。
第四章 几种重要的金属
1.综合知识体系

2.金属的冶炼
